现有X、Y、Z、W四种元素,已知:①X、Y、Z的单质在常温下均为气体;②X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰为苍白色,XZ的水溶液可使紫色石蕊试液变红;③2mol X的单质与1molY的单质化合,生成2mol X2Y,X2Y常温下为液体;④Z的单质溶于X2Y中所得溶液具有漂白性;⑤W原子的最外层电子数和Z原子相同,其单质是深红棕色液体,易挥发.
据此推断:
(1)X______、Y______、W______(均写元素符号);Z的原子结构示意图为______.
(2)写出④中反应的化学方程式:______.
(3)写出 Z的单质工业制法的化学方程式,并标出电子转移的方向和数目______.
W原子的单质是深红棕色液体,易挥发,W为Br元素;
Br原子的最外层电子数和Z原子相同,X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰为苍白色,XZ的水溶液可使紫色石蕊试液变红,故X为H元素,Z为Cl元素;
Z的单质Cl2溶于H2Y中所得溶液具有漂白性,Y的单质在常温下为气体,故Y为O元素;
(1)由上述分析可知,X为H,Y为O,W为Br;
Z为Cl元素,原子核外电子数为17,有3个电子层,最外层电子数为7,原子结构示意图为:

;
故答案为:H、O、Br;

;
(2)④中反应是氯气与水反应生成盐酸与次氯酸,反应方程式为:Cl2+H2O=HCl+HClO;
故答案为:Cl2+H2O=HCl+HClO;
(3)工业上利用电解饱和食盐水取氯气,电解饱和食盐水生成氯气、氢气、氢氧化钠,反应方程式为:2NaCl+2H2O
Cl2↑+H2↑+2NaOH,反应中转移电子数目为2,标出电子转移的方向和数目为: 通电 .
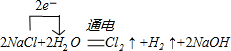
;
故答案为:
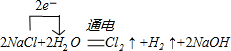
.
