X、Y、Z、W四种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
已知一个B分子中含有的Z元素的原子个数比一个C分子中少一个.而W的单质在常温常压下为固体,并且W元素是形成化合物种类最多的元素.请回答下列问题:
(1)元素X在周期表中的位置______,Y单质的电子式______.
(2)化合物C在一定条件下生成化合物A的化学方程式______.
(3)常温下,将C通入元素Y的最高价氧化物的水化物的水溶液中,恰好完全反应时溶液呈______性(填“酸”、“碱”、“中”);此时溶液中离子浓度由大到小的顺序为______.
(4)由X、Y、Z、W四种元素组成的无机酸酸式盐,与足量的NaOH溶液在加热条件下反应的离子方程式为______.
(5)由X、Z、W三种元素可以形成化合物W2Z6X,其蒸汽通过灼热的氧化铜,黑色的氧化铜会逐渐变红,则该反应的化学方程式为______.
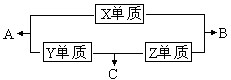
X、Y、Z、W四种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,则三种气体单质为氢气、氮气、氧气.三种气体单质相互反应生成H2O、NH3、NO,一个B分子中含有的Z元素的原子个数比一个C分子中少一个,则B为H2O,C为NH3,Z为氢元素.由关系图可知:Z单质与X单质反应生成B(H2O),故X为氧元素;Z单质与Y单质反应生成C(NH3),故Y为氮元素;所以A为NO.W的单质在常温常压下为固体,并且W元素是形成化合物种类最多的元素,则W为碳元素.
即X为氧元素,Y为氮元素,Z为氢元素,W为碳元素;A为NO,B为H2O,C为NH3.
(1)X为氧元素,原子核外有8个电子,有2个电子层,最外层电子数为,处于周期表中第2周期第ⅥA族.Y为氮元素,其单质为N2,氮原子之间形成3对共用电子对,电子式为
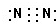
,故答案为:第2周期第ⅥA族;
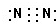
;
(2)C为NH3,A为NO,氨气在催化剂并加热的条件下生成一氧化氮与水,反应方程式为4NH3+5O2
4NO+6H2O,催化剂 . △
故答案为:4NH3+5O2
4NO+6H2O;催化剂 . △
(3)Y为氮元素,最高价氧化物的水化物为HNO3,氨气与硝酸反应生成硝酸铵,硝酸铵属于强酸弱碱盐,铵根离子水解,溶液呈酸性,所以 c(NO3-)>c(NH4+),c(H+)>c(OH-),水解程度不大铵根离子浓度远大于氢离子浓度,所以离子浓度c(NO3-)>c(NH4+)>c(H+)>c(OH-),
故答案为:酸; c(NO3-)>c(NH4+)>c(H+)>c(OH-);
(4)由X、Y、Z、W四种元素组成的无机酸酸式盐为NH4HCO3,NH4HCO3与足量的NaOH溶液在加热条件下反应生成碳酸钠、氨气与水,反应的离子方程式为 NH4++HCO3-+2OH-
NH3↑+2H2O+CO32-,故答案为:NH4++HCO3-+2OH- △ .
NH3↑+2H2O+CO32-; △ .
(5)X为氧元素,Z为氢元素,W为碳元素,三种元素形成化合物C2H6O,其蒸汽通过灼热的氧化铜,黑色的氧化铜会逐渐变红,则该化合物为乙醇CH3CH2OH,该反应的化学方程式为
CH3CH2OH+CuO
CH2CHO+Cu+H2O,故答案为:CH3CH2OH+CuO△
CH2CHO+Cu+H2O.△
