物质A、E、F的焰色反应呈黄色,物质I的分子由4个原子组成并共含有10个电子,B、C、D、K在常温下都是气体单质,G在常温下是无色液体,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如图所示:
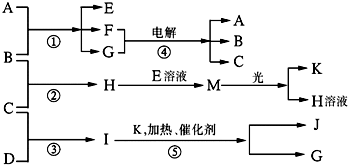
请填写下列空白:
(1)写出下列物质的化学式:B:______;J:______.
(2)写出下列反应的方程式:①反应①的离子方程式:______;②反应⑤的化学方程式:______.
(3)在通常状况下,若1g C气体在B气体中燃烧生成H气体时放出92.3kJ热量,则2mol H气体完全分解生成C气体和B气体的热化学方程式为:______.
I的分子由4个原子组成并共含有10个电子,应为NH3,G在常温下是无色液体,应为H2O,由转化关系可知反应⑤应为氨气的催化氧化,则K为O,J为NO,则C为H2,D为N2,物质A、E、F的焰色反应呈黄色,应都含有钠元素,M在光照条件下可生成O2,应为HClO,则H为HCl,B为Cl2,E为NaClO,A为NaOH,F为NaCl,
(1)由以上分析可知B为Cl2,J为NO,故答案为:Cl2;NO;
(2)①反应①为氯气和氢氧化钠的反应,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
②反应⑤为氨气的催化氧化反应,反应的化学方程式为4NH3+5O2
4NO+6H2O,催化剂 . △
故答案为:4NH3+5O2
4NO+6H2O;催化剂 . △
(3)若1g H2气体在Cl2气体中燃烧生成H气体时放出92.3kJ热量,则1molH2燃烧放出184.6kJ热量,则有2HCl(g)=H2(g)+Cl2(g);△H=+184.6 kJ•mol-1,
故答案为:2HCl(g)=H2(g)+Cl2(g);△H=+184.6 kJ•mol-1.
