问题
填空题
A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大2,C原子的电子总数比B原子的电子总数多4。1mol A的单质跟盐酸反应可置换出11.2L(标准状况)氢气,这时A转变为与氖原子具有相同电子层结构的离子。
试回答:
(1)A是 元素,B是 元素,C是 元素。
(2)分别写出A、B最高价氧化物对应的水化物跟C的气态氢化物水溶液反应的离子方程式: 。
(3)A离子的氧化性比B离子的氧化性 (填“强”或“弱”),这是由于 。
答案
(1)钠 铝 氯
(2)OH-+H+ H2O,
H2O,
Al(OH)3+3H+ Al3++3H2O
Al3++3H2O
(3)弱 钠金属性强于铝,而元素金属性越强,其阳离子的氧化性越弱
1molA单质与足量盐酸反应产生11.2LH2,根据得失电子守恒:
1molA失去电子数=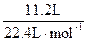 ×2=1mol,则A显+1价。又因与氖原子具有相同的电子层结构,可知A为Na,那么B为Al,C为Cl。
×2=1mol,则A显+1价。又因与氖原子具有相同的电子层结构,可知A为Na,那么B为Al,C为Cl。
