问题
选择题
根据下列短周期元素性质的数据判断,下列说法正确的是
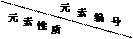 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径/10-10 m | 0.66 | 1.36 | 1.23 | 1.10 | 0.99 | 1.54 | 0.70 | 1.18 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 | A.元素①⑧形成的化合物具有两性 B.元素⑦位于第二周期Ⅴ族 C.元素④⑤形成的化合物是离子化合物 D.元素③的最高价氧化物对应水化物碱性最强
答案
答案:A 本题考查元素的推导与性质,属中档题。由最高正价可以判断出元素所在族,④和⑦位于第VA族,从半径上知,④为P,⑦为N。③⑥均为+1价,为第IA族,又它们均属于短周期元素,从半径分析,它们均比①大,故不可能为H元素,则③为Li,⑥为Na。②的半径比⑥稍小,且为+2价,则应为Mg。同样的原理,不难确定出①⑤⑧分别为O、Cl和Al。①⑧组成的化合物为Al2O3,具有两性,A项正确;B项主族元素应标“A”,错;④⑤可形成PCl3和PCl5,它们均为共价化合物,故错;同主族,从上至下最高价氧化物对应水化物碱性增强,故NaOH的碱性强于LiOH,D项错。 |
