(14分) A、B、C分别是由H、C、O、N、Na、Cu等六种元素中的两种或多种元素组成的化合物。现对A、B、C,D三种化合物分别做以下实验:A是一种蓝色固体,B是无色晶体,其式量为68,C是白色固体。分别取A、B、C三种物质少量于三支试管中,加适量水溶解,发现A不溶于水,B、C都能溶于水,并且用pH试纸测定,B与C的水溶液都显碱性。取A物质少量于一支试管中,后加适量稀盐酸溶解,并用酒精灯微热,发现固体溶解时,伴有气泡产生。将56.8g A隔绝空气加热分解生成40g黑色固体X、无色酸性气体Y(标准状况下,密度为1.96 g/L)和水。生成的Y折合成标准状况下的体积为6.72L。
(1)则A的化学式为 。
(2)取B的水溶液2mL与新制Cu(OH)2混合加热,发现能出现砖红色沉淀。 则物质B为 。
(3)取16.8gC固体加强热,将生成的气体依次通过经称量过的装CaCl2固体的干燥管和装足量Ba(OH)2水溶液的洗气瓶,后经再次称量发现干燥管增重1.8g,洗气瓶增重4.4g。写出C物质加入水后的或电离方程式或离子方程式并说明水溶液显碱性的原因 。
(4)D 是一种含氮质量分数为87.5% 的液态化合物,相对分子质量与空气中某种主要成分的相对分子质量相同,则该物质的结构简式为:___________________;D为一种二元弱碱,则D与过量硫酸反应的产物是____________________ (用化学式表示),D与一种黑色氧化物反应的产物中有一种气态单质及(2)中出现的砖红色物质。写出其化学方程式:__________________________________。
(1)Cu5(OH)4(CO3)3 (2分) (2)HCOONa (2分)
(3) HCO3- H+ + CO32- 、HCO3-+H2O
H+ + CO32- 、HCO3-+H2O  H2CO3 +OH- 水解大于电离(4分)
H2CO3 +OH- 水解大于电离(4分)
(4) 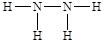 (2分) N2H4HSO4 (2分) N2H4 + 4CuO = 2Cu2O +N2↑+ 2H2O(2分)
(2分) N2H4HSO4 (2分) N2H4 + 4CuO = 2Cu2O +N2↑+ 2H2O(2分)
题目分析:(1)取A物质少量于一支试管中,后加适量稀盐酸溶解,并用酒精灯微热,发现固体溶解时,伴有气泡产生,该气体是二氧化碳。将56.8g A隔绝空气加热分解生成40g黑色固体X、无色酸性气体Y(标准状况下,密度为1.96 g/L)和水。生成的Y折合成标准状况下的体积为6.72L。Y的相对分子质量是1.96×22.4=44,因此Y是CO2,标准状况下的体积是6.72L,物质的量是0.3mol,质量是13.2g,所以生成物水的质量是56.8g-40g-13.2g=3.6g,物质的量是0.2mol。A是一种蓝色固体,说明A中含有铜元素,则40g黑色固体X应该是氧化铜,物质的量是0.5mol,所以铜、碳、氢的个数之比是5:3:4,所以A的化学式为Cu5(OH)4(CO3)3。
(2)取B的水溶液2mL与新制Cu(OH)2混合加热,发现能出现砖红色沉淀,这说明B中含有醛基。B溶液显碱性,能溶于水,根据B的相对分子质量是68可知,因此B是甲酸钠,化学式为HCOONa。
(3)取16.8gC固体加强热,将生成的气体依次通过经称量过的装CaCl2固体的干燥管和装足量Ba(OH)2水溶液的洗气瓶,后经再次称量发现干燥管增重1.8g,洗气瓶增重4.4g。这说明分解生成的水和CO2质量分别是1.8g和4.4g,物质的量分别是0.1mol和0.1mol。由于C溶于水也显碱性,因此C是碳酸氢钠。碳酸氢根的水解程度大于电离程度,因此溶液显碱性,电离方程式和水解方程式分别为HCO3- H+ + CO32- 、HCO3-+H2O
H+ + CO32- 、HCO3-+H2O  H2CO3 +OH-。
H2CO3 +OH-。
(4)D 是一种含氮质量分数为87.5% 的液态化合物,相对分子质量与空气中某种主要成分的相对分子质量相同,空气中的主要成分是氧气和氮气,显然该物质的相对分子质量是32,则含有氮原子的个数是87.5%×32÷14=2,则该化合物是液态肼,因此该物质的结构简式为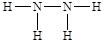 ;D为一种二元弱碱,则D与过量硫酸反应生成酸式盐,则产物是N2H4HSO4。D与一种黑色氧化物反应的产物中有一种气态单质及(2)中出现的砖红色物质,该单质是氮气,砖红色物质是氧化亚铜,黑色物质是氧化铜,因此反应的化学方程式为N2H4 + 4CuO = 2Cu2O +N2↑+ 2H2O。
;D为一种二元弱碱,则D与过量硫酸反应生成酸式盐,则产物是N2H4HSO4。D与一种黑色氧化物反应的产物中有一种气态单质及(2)中出现的砖红色物质,该单质是氮气,砖红色物质是氧化亚铜,黑色物质是氧化铜,因此反应的化学方程式为N2H4 + 4CuO = 2Cu2O +N2↑+ 2H2O。
