(8分,每空1分)已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________________ ,该元素的符号是________
(2)Y元素原子的价层电子的轨道表示式为 ______________ ,
(3)X与Z可形成化合物XZ3,该分子的VSEPR模型名称__________ 该分子的立体构型名称_______
(4) Z原子的电子云是 形,电子云图上的黑点稠密,表明单位体积内电子
(5)比较X的氢化物与同族第三周期元素所形成的氢化物稳定性并从键能角度说明理由
_____________________________________________________________
________________________________________________________________________
(8分,每空1分)
(1)1s22s22p63s23p63d104s24p3 As
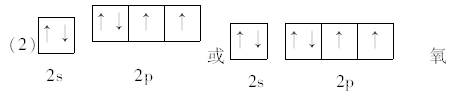
(3)四面体形;三角锥形;
(4)球 电子出现的概率大
(5)稳定性: PH3>AsH3, 因为原子半径As>P,H-As键长大于H-p键长,H-As键能小于H-p的键能。
因为原子半径As>P,H-As键长大于H-p键长,H-As键能小于H-p的键能。
