为了研究金属的性质,老师组织同学们进入实验室去进行活动探究。在实验中,小王同学用大小、外形均相同的铝片分别与H+浓度相同(指的是等体积的酸溶液中H+的数目 相等)的稀盐酸、稀硫酸反应。他意外地发现:铝片与稀盐酸反应放出的气泡的速率明显快于与稀硫酸反应放出气泡的速率。是什么原因导致了反应现象的差异呢?
【问题分析】从微观角度分析,H+浓度相同的盐酸、硫酸中,只是所含____不同。
【提出猜想】 ①Cl-能促进铝和酸的反应,SO42-对反应无影响;
②Cl-对反应无影响,SO42-对反应有抑制铝和酸的反应;
③Cl-能促进铝和酸的反应,SO42-对反应有抑制铝和酸的反应。
【实验探究】见下表:
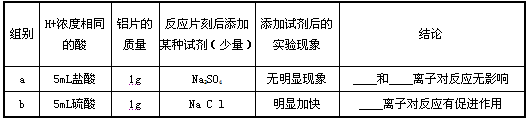
针对上述探究过程回答下列问题:
(1)填写【问题分析】中的空格:____________;
(2)填写上表中的空格:a组结论:__________和___________,b组结论:___________,
(3)【提出猜想】中,成立的是___________;(填写序号①或②或③)
(4)若将b组实验中添加的试剂NaCl改为HCl气体,能否得到同样的结论?请说明原因:__________ 。
(1)酸根离子,
(2)Na+;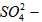 ;Cl-;
;Cl-;
(3)①;
(4)不能,由于HCl气体溶于水生成盐酸,增加了溶液中氢离子的浓度,实验条件发生改变,从而无法说 明Cl-对反应的影响。
