某校兴趣小组同学为探究铁的化学性质,如图进行了以下三个实验,请回答有关问题:
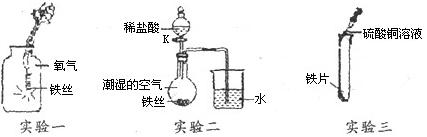
(1)实验一:所发生反应的化学方程式是 (2分),
实验结束后可能产生的不良后果是 ;
(2)实验二:关闭K一段时间后,观察到导管内液面上升;打开K,滴加稀盐酸,观察到导管内液面下降,导管口有气泡冒出,关闭K,导管内液面上升的原因是 ;导管内液面下降的原因是 。(用化学方程式解释)(2分)
(3)实验三:实验观察到的现象是: ,
这一现象说明 (填“铁”或“铜”)的活动性更强。
(1)3Fe+2O2 Fe3O4(2分);集气瓶破裂
Fe3O4(2分);集气瓶破裂
(2)铁生锈消耗了瓶内的氧气,瓶内气压小于外界大气压,液面上升;Fe+2HCl=FeCl2+H2↑
(3)有红色固体析出,蓝色溶液变浅绿色;铁
题目分析:(1)实验一是铁丝燃烧的实验,所以反应的化学方程式是:3Fe+2O2 Fe3O4,实验前要在瓶底集气瓶底部铺少量的细沙或加少量的水,防止生成的固体物质溅落瓶底,致使集气瓶炸裂
Fe3O4,实验前要在瓶底集气瓶底部铺少量的细沙或加少量的水,防止生成的固体物质溅落瓶底,致使集气瓶炸裂
(2)铁在有空气、水的情况下,会生锈,关闭K一段时间后,铁生锈消耗了瓶内的氧气,瓶内气压小于外界大气压,液面上升,打开K,滴加稀盐酸,铁会与稀盐酸反应生成氢气,使烧瓶内的气体增多,压强增大,所以观察到导管内液面下降,发生的反应化学方程式:Fe+2HCl=FeCl2+H2↑
(3)由于铁的活动性比铜强,所以铁能置换出硫酸铜溶液中的铜,所以现象是:有红色固体析出,蓝色溶液变浅绿色
