Speaking of Copenhagen, what do you think of? The little Mermaid, the fairy tale writer H.C. Anderson, the COP15 meetings , or a city where people bike even though they have cars.
When landing on Copenhagen Tasstrup Airport, you can see numbers of white propeller generators standing in the blue waterfront. The constant moving paddles are producing renewable energy to the city. During the recent Climate Change Conference, the city was introduced to the world as an example of climate-friendly city. Evidences other than wind power stations were obvious everywhere.
While private cars can be a great source of pollution in other cities, the main form of transport in the capital of Denmark is, however, public transportation. By public transportation, I mean one of very good quality. Buses are usually Volvo and most of the traffic lights are of Siemens. Additionally, buses, metros and intercity-trains (named S-train) are well equipped, constantly maintained, special and good-looking. The seats in the trains are of sofa-designed. Sticky gum or dirty spot rarely appear. Thanks to a small population, it is much easier to maintain the condition of the vehicles. Free wireless internet service is provided in S-trains. Seats are always possible even at rush hours if the passenger is patient enough to look for it. Taking the convenience for granted, Danish people find it hard to imagine how the metro in Tokyo can be as crowded as a “sardin can”. Pets and baby-wagons are allowed in buses, subways and S-trains. All the facilities enable better service to bigger passenger group. It is also notable that the mass transit uses green fuels and electricity.
Cars are common in Copenhagen, but people have an alternative of short distance transport: bikes. Denmark is known as bike-friendly for many reasons, such as flat land, splendid cycle ways, and the Danish fond of motion. But please be aware that riding a bike in Copenhagen is not like biking in Beijing. First of all, it is quite speedy. Many people ride to work every morning. Punctuality is important and they have to ride as fast as possible to be on time. So why not speed up? Not my philosophy. As a result, I am often hastened by impatient riders who unfortunately piled up after me. Second, considering the speed, bike helmets, front and back lights and other necessary accessories are required. Riders need to set a white light in the front of the bike and red light at the back. One may end up with a big fine if not riding with them.
72. In the passage we get to know that _____.
all energy come from wind power stations
different kinds of green energy keep this city running
a lot of electricity is imported from other countries
people in this city use little energy
73. S-trains are a kind of transportation______.
A. which send their passengers from one city to another.
B. which uses wind to run their ways
C. which is the only way for you to go from one city to another.
D. which you are not allowed to take if you take a pet.
74. In the last paragraph what does “Punctuality” mean?
A. Being fit B. Not being scolded C. Not being late D. Speeding
75. In Copenhagen if you ride too slow ,_____
A. you will be fined by police.
B. it means that you need to buy a better bike.
C. you may block the traffic flow.
D. many bike riders will shout at you.
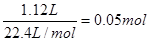 ,所以转移电子的物质的量为0.05mol×2=0.1mol。根据得失电子守恒可知金属的化合价为
,所以转移电子的物质的量为0.05mol×2=0.1mol。根据得失电子守恒可知金属的化合价为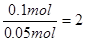 ,又因为金属离子具有Ar原子的电子层结构,所以该金属的原子序数为18+2=20,即为钙元素。所以答案是D。
,又因为金属离子具有Ar原子的电子层结构,所以该金属的原子序数为18+2=20,即为钙元素。所以答案是D。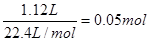 ,所以转移电子的物质的量为0.05mol×2=0.1mol。根据得失电子守恒可知金属的化合价为
,所以转移电子的物质的量为0.05mol×2=0.1mol。根据得失电子守恒可知金属的化合价为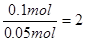 ,又因为金属离子具有Ar原子的电子层结构,所以该金属的原子序数为18+2=20,即为钙元素。所以答案是D。
,又因为金属离子具有Ar原子的电子层结构,所以该金属的原子序数为18+2=20,即为钙元素。所以答案是D。