(11分)有四种短周期元素,它们的结构、性质等信息如下表所述:
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
(1)A原子的核外电子排布式
____________________________________________________________。
(2)B元素在周期表中的位置__________;离子半径:B______A(填“大于”或“小于”)。
(3)C原子的电子排布图是__________ ,其原子核外有______个未成对电子,能量最高的电子为______轨道上的电子,其轨道呈______ 形。
(4)D原子的电子排布式为________,D-的结构示意图是______ 。
(5)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为______ _,与D的氢化物的水化物反应的化学方程式为_______________。
(1)1s22s22p63s1 (2)第三周期第ⅢA族 小于
(3) 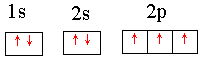 3 p 哑铃
3 p 哑铃
(4)1s22s22p63s23p5或[Ne]3s23p5 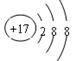
(5)NaOH+Al(OH)3===NaAlO2+2H2O 3HCl+Al(OH)3===AlCl3+3H2O
根据题中信息可推出:A为Na,B为Al,C为N,D为Cl。
(1)A为Na,其核外电子排布式为1s22s22p63s1。
(2)B为Al,在元素周期表中的位置为第三周期第ⅢA族,Na+与Al3+核外电子排布相同,核电荷数Al3+大于Na+,故r(Al3+)<r(Na+)。
(3)C为N,其电子排布图为 ,其中有3个未成对电子,能量最高的为p轨道上的电子,其轨道呈哑铃形。
,其中有3个未成对电子,能量最高的为p轨道上的电子,其轨道呈哑铃形。
(4)D为Cl,其核外电子排布式为1s22s22p63s23p5,简化电子排布式为[Ne]3s23p5,Cl-的结构示意图为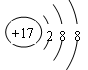 .
.
(5)本题考查Al(OH)3与NaOH和HCl反应的方程式,
Al(OH)3+NaOH===NaAlO2+2H2O,Al(OH)3+3HCl===AlCl3+3H2O。
