(16分)X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
⑵X的电负性比Y的 (填“大”或“小”);X和Y的气态氢化物中,较稳定的是 (写化学式)
⑶写出Z2Y2与XY2反应的化学方程式,并标出电子转移的方向和数目: 。
⑷在X原子与氢原子形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称: 。氢元素、X、Y的原子也可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式: 。
⑴4 Ⅷ 2 ⑵小 H2O ⑶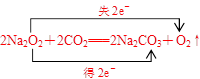
⑷丙烷(其他答案合理也给分) CH3COOH+HCO-3=CH3COO-+H2O+CO2↑
由题中信息可推知X、Y、Z、W分别为C、O(n=2)、Na(根据质量数=质子数+中子数推得)、Fe(根据氢氧化物由白色变为灰绿色最后为红褐色)四种元素。⑴Fe位于周期表第4周期第Ⅷ族元素,其基态原子价电子排布式为3d64s2,最外层有2个电子。⑵根据同一周期电负性自左向右逐渐增大,非金属性逐渐增强知X(C)的电负小比Y(O)的小,X的气态氢化物CH4没有Y的氢化物H2O稳定,而H2O比H2O2稳定。⑶Na2O2与CO2反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,在标电子转移的方向和数目时,应注意Na2O2中氧元素化合价为-1价。⑷本小题为发散型试题,答案不唯一。烃分子中含有两种氢原子的烃较多,如丙烷(CH3CH2CH3)、正丁烷(CH3CH2CH2CH3)、丙炔(CH3C≡CH)等,由C、H、O三种元素形成的分子很多,但形成的无机阴离子只有HCO-3,而能与HCO-3反应的分子必须为羧酸,如CH3COOH等。
考点定位:本题以元素推断题为依托考查原子结构、元素周期表、元素周期律知识、核磁共振氢谱、氧化还原反应及离子方程式的书写,旨在考查考生对物质组成、结构、性质与元素在周期表中的位置的关系的综合应用能力,考查学生的发散思维能力。
