在测定黄铜(铜锌合金)中铜元素的含量时,小明设计如图实验:取一定质量的黄铜粉碎后向其中加入过量的稀硫酸,测定产生气体的体积,经过计算先测定锌的含量,试回答:
(1)实验中发生的化学反应方程式为:______;
(2)预测观察到A中的现象是______
;用理化知识解释此实验能测定生成气体体积的原因______;小霞认为将导管a插入水中,测定气体的体积更准确一些,她的理由是______;
(3)测定黄铜中铜的含量,你还有简单的方案是______.
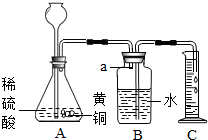
(1)铜锌合金中的铜不能与稀硫酸反应,而锌能,所以实验中发生反应的方程式为:Zn+H2SO4═ZnSO4+H2↑;
(2)由于该反应有气体放出,所以观察到A中的现象是金属表面有气泡产生;实验能测定生成气体体积的原因是氢气难溶于水,随着生成的氢气量的不断变大,导致B瓶内气压增大,在一定压强差的作用下,将水压入量筒,且量筒中的水量与该气体的体积相等;将导管a插入水中的好处是:该反应放热,导管a插入水中,水能吸热,减小温度对气体体积的影响(其它答案合理均可);
(3)要想测定黄铜中铜的含量,还可以利用合金中锌能与稀硫酸反应而铜不能的原理,将一定质量的黄铜粉溶解在过量的稀硫酸中,过滤称量铜的质量,便能测出铜的含量;
故答案为:(1)Zn+H2SO4═ZnSO4+H2↑;
(2)产生的气体难溶于水,B瓶内气压增大,在一定压强差的作用下,将水压入量筒;该反应放热,导管a插入水中,水能吸热,减小温度对气体体积的影响(其它答案合理均可);(3)将一定质量的黄铜粉溶解在过量的稀硫酸中,过滤称量铜的质量,便能测出;
