问题
填空题
已知数列{an}中,a1=1,an+1-an=
|
答案
因为an=(an-an-1)+(an-1+an-2)++(a2-a1)+a1=
+1 3n
++1 3n-1
+11 32
所以an是一个等比数列的前n项和,所以an=
,且q=2.代入,1-qn 1-q
所以
an=1+lim n→∞
=1 32 1- 1 3
.7 6
所以答案为7 6
已知数列{an}中,a1=1,an+1-an=
|
因为an=(an-an-1)+(an-1+an-2)++(a2-a1)+a1=
+1 3n
++1 3n-1
+11 32
所以an是一个等比数列的前n项和,所以an=
,且q=2.代入,1-qn 1-q
所以
an=1+lim n→∞
=1 32 1- 1 3
.7 6
所以答案为7 6
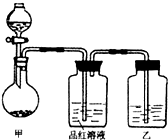
某同学在学习“硫酸及其盐的某些性质与用途“中,进行如下实验探究.
【实验一】探究浓硫酸的氧化性
将实验室常用的药品放入如右图所示的实验装置后,加热装置甲.(夹持和加热装置省略)
(1)该装置设计上存在明显缺陷,请指出:______.
(2)写出装置甲中反应的化学方程式______.
(3)装置乙中的试剂是______.
【实验二】探究某硫酸亚铁盐固体是否变质
(4)请你帮助该同学完成如下实验方案:
| 实验操作 | 预期现象和结论 |
查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如图:
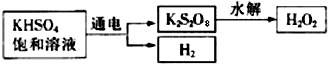
该同学用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数.
①取5.00mL H2O2溶液(密度为1.00g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化;
②用0.1000mol/L KMnO4溶液滴定;
③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00mL、19.98mL、20.02mL.
回答下列问题:
(5)电解饱和KHSO4溶液时,阳极的电极反应式为______.
(6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快.Mn2+的作用是______.
(7)写出该滴定反应的离子方程式:______.
(8)原H2O2溶液中溶质的质量分数为______.