某同学在学习“硫酸及其盐的某些性质与用途“中,进行如下实验探究.
【实验一】探究浓硫酸的氧化性
将实验室常用的药品放入如右图所示的实验装置后,加热装置甲.(夹持和加热装置省略)
(1)该装置设计上存在明显缺陷,请指出:______.
(2)写出装置甲中反应的化学方程式______.
(3)装置乙中的试剂是______.
【实验二】探究某硫酸亚铁盐固体是否变质
(4)请你帮助该同学完成如下实验方案:
| 实验操作 | 预期现象和结论 |
查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如图:
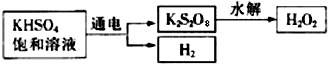
该同学用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数.
①取5.00mL H2O2溶液(密度为1.00g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化;
②用0.1000mol/L KMnO4溶液滴定;
③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00mL、19.98mL、20.02mL.
回答下列问题:
(5)电解饱和KHSO4溶液时,阳极的电极反应式为______.
(6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快.Mn2+的作用是______.
(7)写出该滴定反应的离子方程式:______.
(8)原H2O2溶液中溶质的质量分数为______.
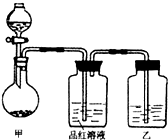
(1)装置乙中有瓶塞,当气压达到一定程度时,这样产生的尾气不会进入瓶中,达不到尾气处理装置,
故答案为:装置乙不应有瓶塞;
(2)装置是固体和浓硫酸的反应,金属铜、非金属单质C等均可以和浓硫酸反应,即Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O或C+2H2SO4(浓) △ .
CO2↑+2SO2↑+2H2O, △ .
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O (或C+2H2SO4(浓) △ .
CO2↑+2SO2↑+2H2O) △ .
(3)尾气处理二氧化硫的溶液是氢氧化钠或是氢氧化钾,故答案为:氢氧化钠溶液(或氢氧化钾溶液等);
(4)亚铁离子易很容易被氧化为三价铁离子,可以用硫氰酸钾来检验,即三价铁离子往一支试管中加入少量固体,加水溶解,再滴加几滴KSCN溶液;若溶液变为红色,说明该固体已变质,若溶液未变红色,说明该固体没有变质,
故答案为:三价铁离子往一支试管中加入少量固体,加水溶解,再滴加几滴KSCN溶液;若溶液变为红色,说明该固体已变质,若溶液未变红色,说明该固体没有变质;
(5)电解饱和KHSO4溶液时,阳极是阴离子发生失电子的氧化反应,电极反应式为2HSO4--2e-=S2O82-+2H+(或2SO42--2e-=S2O82-),故答案为:2HSO4--2e-=S2O82-+2H+(或2SO42--2e-=S2O82-);
(6)在双氧水的分解过程中,高锰酸钾具有氧化性,对应的还原产物是锰离子,当加入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快,可见是锰离子起到催化剂的作用,
故答案为:催化剂(或加快反应速率);
(7)高锰酸根离子有强氧化性,可以将双氧水氧化,原理方程式为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,
故答案为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑;
(8)三次消耗KMnO4溶液的体积分别为20.00mL、19.98mL、20.02mL,则体积平均值为:20.00mL,则消耗高锰酸根的量:0.1mol/L×0.02L=0.002mol,设双氧水的物质的量为n,则
2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
2 5
0.002mol n
解得n=0.005mol,所以双氧水的质量为:0.005mol×34g/mol=0.17g,双氧水的质量分数=
×100%=3.4%,故答案为:3.4%.0.17g 5.00mL×1.00g/mL
