水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是
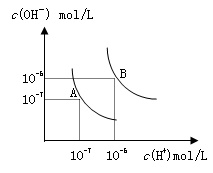
A.纯水中25℃时的c(H+)比100℃时的c(H+)大
B.100℃时某溶液中由水电离产生的c(H+)=1×10-11mol/L,则该溶液的pH可能是11或3
C.将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10: 1
D.25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中c(Na+):c(OH-)为104:1
答案:D
题目分析:A、水的电离为吸热反应,升高温度,水的电离程度增大,氢离子浓度增大,所以纯水中25°C时的c(H+)比100℃的时c(H+)小,错误;B、根据题给图像知,100℃时水的离子积为10-12,由水电离产生的c(H+)=1×10-11mol•L-1,若溶液为酸性溶液,氢离子浓度为:0.1mol/L,溶液的pH=1;若溶液为碱性溶液,则溶液中氢离子浓度为1×10-11mol•L-1,溶液pH=11,错误;C、100℃时水的离子积为10-12,混合溶液的pH=7,反应后的溶液为碱性溶液,溶液中氢离子浓度为1×10-7mol•L-1,氢氧根离子浓度为1×10-5mol•L-1; pH=9的Ba(OH)2溶液中氢氧根离子浓度为1×10-3mol•L-1,与pH=4的稀盐中氢离子浓度为1×10-4mol•L-1,设氢氧化钡的体积为x,盐酸溶液的晶体为y,则:(10−3x−10−4y)/(x+y) =1×10-5,解得x:y=1:10,错误;D、25℃时,氢离子浓度为1.0×10-7mol/L,钠离子浓度为1.0×10-3mol/L,则溶液中c(Na+):c(OH-)=1.0×10-3mol/L:1.0×10-7mol/L=104:1,正确。
