W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目; W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强。

(1)Y在周期表中的位置是 。
(2)用电子式解释X与W能形成化合物X3W的原因 。
(3)X3W遇水可释放出使酚酞溶液变红的气体A,化学方程式是 。
(4)用惰性电极电解化合物XZ溶液从阴极释放出气体B,反应的离子方程式是 。
(5)已知W的单质与气体B在一定条件下可形成气体A,即: W2 (g)+3B (g) 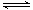 2A(g) △H =-92.4 kJ・mol―1
2A(g) △H =-92.4 kJ・mol―1
在某温度时,一个容积固定的密闭容器中,发生上述反应。在不同时间测定的容器内各物质的浓度如下表:
| 时间 | 浓度(mol/L) | ||
| c(W2) | c(B) | c(A) | |
| 第0 min | 4.0 | 9.0 | 0 |
| 第10min | 3.8 | 8.4 | 0.4 |
| 第20min | 3.4 | 7.2 | 1.2 |
| 第30min | 3.4 | 7.2 | 1.2 |
| 第40min | 3.6 | 7.8 | 0.8 |
①W2的平均反应速率v(0min~10min)/ v(10min~20min) = ;
②反应在第10min改变了反应条件,改变的条件可能是 ;
a.更新了催化剂 b.升高温度 c.增大压强 d.增加B的浓度
③若反应从第30min末又发生了一次条件改变,改变的反应条件可能是 ;
a.更新了催化剂 b.升高温度 c.增大压强 d.减小A的浓度
(1) 第三周期、第ⅥA族 (2)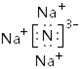
(3)Na3N+3H2O =NH3↑+3NaOH
(4)2Cl-+2H2O  Cl2↑+H2↑+2OH-(5)① 1/2 ② a、b ③ b
Cl2↑+H2↑+2OH-(5)① 1/2 ② a、b ③ b
题目分析:根据质子数=质量数-中子数,可以推断W是N,X的离子与NH4+具有相同的质子、电子数目,说明X是Na,SO2能形成酸雨,所以Y是S,Z的原子序数比S大,非金属性更强,Z是Cl。N位于周期表中第三周期、第ⅥA族,Na金属性强,和N形成离子化合物Na3N,Na3N和水发生水解生成氨气和NaOH,电解NaCl溶液氯碱工业的原理,注意条件;(5)根据1:3反应可以推断出是工业合成氨气,3H2+N2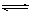 2NH3,v(0min~10min)/ v(10min~20min) =
2NH3,v(0min~10min)/ v(10min~20min) = 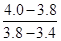 =
= 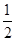 ,第10-20min反应速率增加,所以可以加快速率的条件有a b d但是d改变B的浓度,有数据可看出B的浓度未增加,可以排除d;第30min,改变条件,平衡逆向移动,升高温度,平衡向吸热反应方向移动。
,第10-20min反应速率增加,所以可以加快速率的条件有a b d但是d改变B的浓度,有数据可看出B的浓度未增加,可以排除d;第30min,改变条件,平衡逆向移动,升高温度,平衡向吸热反应方向移动。
