β型硼氮化合物—-(BN)n是一种无机合成材料[最简式为(BN)],具有高硬度、耐高温的特点,是做超高温耐热陶瓷材料、磨料、精磨刃具的好材料。用硼砂(Na2B4O7)与尿素在高温高压下反应可以获得。例如: Na2B4O7 + 2CO(NH2)2 → 4(BN) + Na2O + 2CO2
(1)请用氧化物的形式表示硼砂的化学式 。β型(BN)n比晶体硅具有更高硬度和耐热性的原因是: 。
(21)上述反应式中具有4种不同能量电子的原子,它代表的元素在周期表中处于第 周期,第 族。
(3)能用于比较N与O非金属性相对强弱的事实是 。
A.最高价氧化物对应水化物的酸性
B.H2O(g) 比NH3(g)稳定
C.单质与H2反应的难易程度
D.NO中氮元素显正价,氧元素显负价(4)写出生成物中含极性键的非极性分子的电子式为 。
(5)与硼同主族且相邻周期的元素,其最高价氧化物与NaOH溶液反应的离子方程式 为: 。
(1)Na2O·2B2O3 它属于原子晶体,B-N键长比Si-Si键短(或B-N键能较大)
(2)第三周期,第ⅠA 族
(3)D
(4)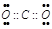
(5)Al2O3+2OH-+→2AlO2-+H2O
题目分析:(1)二者都属于原子晶体,一般来说,原子半径越小,形成共价键的键长越短,键能越大,其晶体熔沸点越高。B-N键长比Si-Si键短,故型(BN)n比晶体硅具有更高硬度和耐热性。
(2)具有4种不同能量电子的原子为钠原子,电子排布式为1S22S22P63S1,故为第三周期,第ⅠA 族。
(3)非金属性强弱比较可依据以下几点:1,同周期中,从左到右,随核电荷数的增加,非金属性增强;同主族中,由上到下,随核电荷数的增加,非金属性减弱;2,依据最高价氧化物的水化物酸性的强弱:酸性愈强,其元素的非金属性也愈强;3,依据其气态氢化物的稳定性:稳定性愈强,非金属性愈强;4,与氢气化合的条件;5,与盐溶液之间的置换反应。A选项,由于O元素没有含氧酸,故A错误。B选项正确。C选项,单质与H2反应的难易程度,说明单质的氧化性强弱,单质的结构不同,不能说明元素的非金属性,故错误。D选项,化合价说明共用电子对偏移方向,化合物中表现负价的元素,对键合电子的吸引力更强,非金属性更强,N元素吸引电子能力更强,故非金属性N>O,可以比较。D正确。
(4)生成物中含极性键的非极性分子为二氧化碳,故其电子式为: 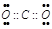
(5)与硼同主族且相邻周期的元素只有Al元素。故,与NaOH溶液反应的离子方程式为:Al2O3+2OH-+→2AlO2-+H2O