A、B、C、D、E五种短周期元素,A与D同周期,A的单质既可与盐酸反应,又可与NaOH溶液反应,B的单质在放电条件下能与氧气反应,C元素的离子不含电子,D元素原子的最外层电子数是其次外层电子数的3/4,E元素原子的最外层电子数是其次外层电子数的3倍。
(1)A的原子结构示意图为 。
(2)0.1 mol/L A的硫酸盐溶液与0.1 mol/L NaOH溶液等体积混合,反应的离子
方程式为 。
(3)以A的单质和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池总反应的化学方程式是 。
(4)化合物甲由元素A、B组成,具有良好电绝缘性。
化合物甲能与水缓慢反应生成含B的化合物乙,乙分子中含有10个电子。写出该
反应的化学方程式: 。
工业用A的单质和化合物乙在高于1700K反应制备甲。已知该反应可以认为是置
换反应,该反应的化学方程式是 。
(5)D和E两种元素相比较,非金属性较强的是(填元素名称) ,可以验证该结论的是(填写编号) ;
a.比较这两种元素的常见单质的沸点
b.比较这两种元素的单质与氢气化合的难易
c.比较这两种元素的气态氢化物的稳定性
(6)C、D、E间可形成丙、丁两种分子,它们均含有18个电子,则丙与丁反应生成D单质的化学方程式为 ;
(1)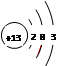 (1分)
(1分)
(2)Al3+ + 3OH-= Al(OH)3↓(2分)
(3)Al+3NiO(OH)+H2O+NaOH==NaAlO2+3Ni(OH)2(2分)
(4)AlN + 3H2O = Al(OH)3↓+ NH3↑(2分) 2Al + 2NH3 2AlN + 3H2(2分)
2AlN + 3H2(2分)
(5)氧(1分)bc (2分) (6)H2S+H2O2=S↓+2H2O(2分)
题目分析:A、B、C、D、E元素分别为Al、N、H、S、O;(2)氢氧化钠量不足生成氢氧化铝沉淀;(3)Ni化合价由+3价变为+2价,铝化合价升高碱性介质中生成偏铝酸盐,故方程式为 Al+3NiO(OH)+H2O+NaOH==NaAlO2+3Ni(OH)2;(4)甲为AlN,水解为Al(OH)3和NH3;(5)非金属性强弱可以通过与氢气化合的能力,氢化物的稳定性、最高价氧化物对应水化物酸性强弱判断;(6)H、S、O三种元素形成的18电子分子为H2S和H2O2,它们能发生氧化还原反应。
