现有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A与D、C与E
分别同主族,D、E、F同周期。A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C可形成电子总数相等的分子,且A与C、A与E、A与F也可以形成电子总数相等的分子。
请回答下列问题:
(1)元素F在周期表中的位置________________________________________________。
(2)A、C、D三种元素可组成一种常见化合物,该化合物的化学式为________;工业生产该化合物和单质F的离子方程式为_________________________________________。
(3)B与F形成的化合物分子中,各原子最外层均达8电子结构,则该分子的电子式为________________________________________________________________________。
(4)已知0.50 mol EC2被C2氧化成气态EC3,放出49.15 kJ热量,其热化学方程式为_________________________________________________________________________。
(5)A、B、C以原子个数比4∶2∶3所形成的化合物,所含的化学键类型为____________。
0.1 mol·L-1该化合物水溶液中的离子浓度由大到小的顺序为_________________________________________________________。
(1)第三周期第Ⅶ A族
(2)NaOH2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
(3)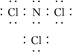
(4)2SO2(g)+O2(g)=2SO3(g)ΔH=-196.6 kJ·mol-1(或SO2(g)+1/2O2(g)=SO3(g)ΔH=-98.3 kJ·mol-1)
(5)离子键和(极性)共价键 c(NO3-)>c(NH4+)>c(H+)>c(OH-)
短周期元素形成电子总数相等的分子,不是10电子分子,就是18电子分子;A分别与B、C可形成电子总数相等的分子,该分子是10电子分子;A与C、E、F也可以形成电子总数相等的分子,则该分子只能为18电子分子;A元素为氢元素,C元素为氧元素,则B元素为氮元素,D元素为钠元素,E元素为硫元素,F为氯元素。
(1)元素F(氯)在周期表中的位置是第三周期第ⅦA族。
(2)A、C、D三种元素可组成的一种常见化合物为NaOH,工业上生产该化合物和单质F(Cl2)的方法为电解饱和食盐水,其离子方程式为2Cl-+2H2O Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
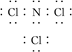 (3)B与F形成的化合物分子NCl3中,氮原子最外层5个电子,需要3个电子使原子最外层达8电子结构,氯原子最外层7个电子,需要1个电子使原子最外层达8电子结
(3)B与F形成的化合物分子NCl3中,氮原子最外层5个电子,需要3个电子使原子最外层达8电子结构,氯原子最外层7个电子,需要1个电子使原子最外层达8电子结
构,则该分子的电子式为 。
(4)0.50 mol SO2被O2氧化成气态SO3,放出49.15 kJ热量,则1.0 mol SO2被O2氧化成气态SO3放出98.3 kJ热量,2.0 mol SO2被O2氧化成气态SO3,放出196.6 kJ热量,热化学方程式为2SO2(g)+O2(g)=2SO3(g) ΔH=-196.6 kJ·mol-1或SO2(g)+1/2O2(g)=SO3(g)ΔH=-98.3 kJ·mol-1。
(5)A、B、C以原子个数比4∶2∶3所形成的化合物为NH4NO3,属于盐类,为离子化合物,所含的化学键类型为离子键和(极性)共价键;NH4NO3是一种强酸弱碱盐,水溶液呈酸性,离子浓度由大到小的顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-)。
