A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,能生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为 ,B为 ,C为 ,D为 。(填元素符号)
(2)D的最高价氧化物的水化物的化学式是 ,E的电子式是 。
(3)写出由A、B组成的化合物与E反应的化学方程式: 。
(4)请用电子式表示出C和D形成的化合物F的形成过程: 。
(1)C 、O 、Na 、S
(2)H2SO4 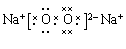
(3)2CO2 + 2Na2O2 = 2Na2CO3 + O2
(4)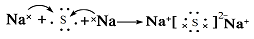
题目分析:(1)A原子的最外层上有4个电子,则A核外电子排布为2、4.所以A是C元素;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,能生成一种淡黄色的固体E;则B是O元素;C是Na元素,形成的淡黄色的固体E是Na2O2。D的L层电子数等于K、M两个电子层上的电子数之和。则D是S元素。(2)S最外层有6个电子,所以其的最高价氧化物的水化物的化学式是H2SO4。Na2O2是含有非碱性共价键的离子化合物。其电子式为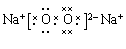 。(3)由C、O组成的化合物CO2与Na2O2反应的化学方程式:2CO2 + 2Na2O2 = 2Na2CO3 + O2。(4)Na和S形成的化合物Na2S的形成过程的电子式表示为:
。(3)由C、O组成的化合物CO2与Na2O2反应的化学方程式:2CO2 + 2Na2O2 = 2Na2CO3 + O2。(4)Na和S形成的化合物Na2S的形成过程的电子式表示为: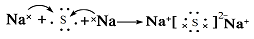 。
。
