图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图B所示。
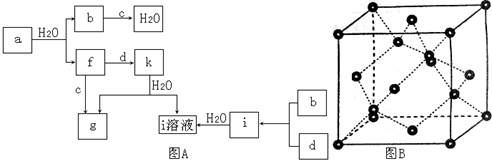
回答下列问题:
(1)图B对应的物质名称是 ,其晶胞中的原子数为 ,晶体的类型为 。
(2)d中元素的原子核外电子排布式为 。
(3)图A中由二种元素组成的物质中,沸点最高的是 ,原因是 ,该物质的分子构型为 ,中心原子的杂化轨道类型为 。
(4)图A中的双原子分子中,极性最大的分子是 。
(5)k的分子式为 ,中心原子的杂化轨道类型为 ,属于 分子(填“极性”或“非极性”)。
(1)金刚石 8 原子晶体
(2)1s22s22p63s23p5
(3)H2O 分子间形成氢键 V形(或角形) sp3
(4)HCl
(5)COCl2 sp2 极性
选这一试题,熟悉命考常高频热点,更要让同学们知道命题人的思想更新,因为不断创新,是进步的根本。常见元素单质及化合物相互关系到融合在元素推断中,这一思想是近几年的亮点。根据题中条件和所给转化关系可知,a为C单质,b为H2,C为O2,d为Cl2,i为HCl;
(1)图B对应的物质为金刚石,C原子的个数为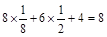 ,金刚石属于原子晶体;
,金刚石属于原子晶体;
(3)图A中两种元素形成的化合物中,水由于分子间存在氢键,沸点高。H2O为V形分子,O中有2对孤电子对,杂化类型为sp3
(4)图A中双原子分子中,HCl的极性最大。
(5)COCl2的中心原子C无孤电子对,杂化类型为sp2,为极性分子。
