某化学兴趣小组利用课余时间在实验室进行如下两个探究实验:
【探究一】利用废水回收铜,制备硫酸亚铁晶体。
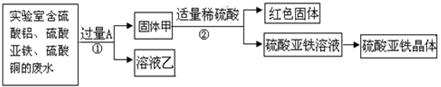
(1)红色固体是 (填化学式);溶液乙中溶质是 。
A.硫酸铝
B.硫酸亚铁
C.硫酸铝和硫酸亚铁
D.硫酸铜和硫酸铝(2)写出步骤①的化学方程式: ;
【探究二】某硫酸亚铁晶体(FeSO4·xH2O)热分解研究并对x的测定
该兴趣小组同学称取ag硫酸亚铁晶体样品,先通干燥的氮气,然后按下图装置高温加热,使其完全分解,对所得产物进行探究。
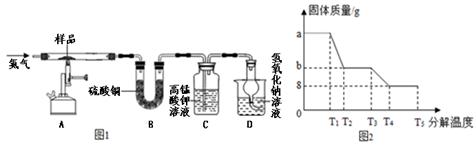
(3)装置B中硫酸铜粉末变蓝,说明产物中有 ,称量反应后装置B,增重12.6g
(4)装置C中 ,说明产物中还有SO2。
查阅资料得知二氧化硫气体能与高锰酸钾溶液发生如下反应:
5SO2 + 2KMnO4 + 2H2O X + 2MnSO4 + 2H2SO4 ,则X的化学式是 。
(5)硫酸亚铁晶体完全分解后装置A中固体呈红棕色,放入足量稀盐酸,固体全部溶解,得到黄色溶液,则装置A中红棕色固体是 。
(6)D装置中球形干燥管的作用是 ,氢氧化钠溶液的作用是 。
(7)反应结束后还要不断的通入氮气直至冷却,其目的是 。
【数据处理】
兴趣小组同学利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量--分解温度的关系图(图2)
①根据图2中有关数据,可计算出FeSO4•xH2O中的x值是 (要求写出计算过程)。
②从理论上分析得出硫酸亚铁分解还生成另一物质SO3,请写出T3—T4段发生反应的化学方程式 。
③上述试验中若将装置B和装置C进行调换,则测得FeSO4•xH2O中的x值会 (填“偏大”“偏小”或“不变”)
(1)Cu;C (2)Fe+CuSO4="Cu+" FeSO4;(3)水;(4)高锰酸钾溶液褪色;K2SO4;(5)Fe2O3;(6)防止溶液倒吸;吸收SO2气体,防止污染空气;(7)把装置中水蒸气全部赶入装置B中;①X=7(计算过程完整);②2FeSO4△ Fe2O3+ SO2↑+ SO3↑;③偏大
题目分析:【探究一】:由题意可知,从含有硫酸铝、硫酸亚铁和硫酸铜的废水中回收铜和硫酸亚铁,加入的过量的金属A应是铁;(1)由上述分析可知,步骤①发生的反应是铁与硫酸铜的反应,化学方程式是:Fe+CuSO4═FeSO4+Cu;(2)由于铁与硫酸铜反应生成了铜和硫酸亚铁,所以红色固体是Cu;由于铁不能与硫酸铝反应,所以溶液乙中的溶质是 Al2(SO4)3、FeSO4.
【探究二】:(3)装置B中硫酸铜粉末变蓝,说明产物中有水;(4)装置C中高锰酸钾褪色,说明产物中还有SO2.在反应中5SO2+2KMnO4+2H2O=2H2SO4+2MnSO4+X,反应前含有5个硫原子,2个钾原子,2个锰原子,4个氢原子,20个氧原子,反应后已有4个氢原子,2个锰原子,4个硫原子,16个氧原子,根据质量守恒定律可知,X中含有2个钾原子,1个硫原子和4个氧原子,故X为K2SO4;(5)红棕色固体放入足量稀盐酸,固体全部溶解,得到黄色溶液,说明该固体为氧化铁;(6)D装置中球形干燥管的作用是防止溶液倒吸,氢氧化钠溶液的作用是:吸收二氧化硫、防止污染空气;(7)装置内内充满了反应生成的水蒸气,反应结束后还要不断的通入氮气直至冷却,其目的是:把装置中的水蒸气全部赶入装置装置B中;①通过FeSO4•xH2O的化学式可知铁原子和水的个数比为1:2x,由图象中的数据可知,
Fe2O3~2xH2O
160 36x
8g 12.6g
x=7
②由题意和图象可知,硫酸亚铁受热分解生成了氧化铁二氧化硫和三氧化硫,反应的方程式是:2FeSO4△Fe2O3+SO2↑+SO3↑;③气体先通入溶液时会引入水蒸气,会使计算的X值偏大.
