(15分)有文献记载:在强碱条件下,加热银氨溶液可能析出银镜。某同学进行如下验证和对比实验。
| 装置 | 实验序号 | 试管中的药品 | 现象 |
 | 实验Ⅰ | 2mL银氨溶液和数 滴较浓NaOH溶液 | 有气泡产生: 一段时间后,溶液 逐渐变黑:试管壁 附着银镜 |
| 实验Ⅱ | 2mL银氮溶液和 数滴浓氨水 | 有气泡产生: 一段时间后,溶液 无明显变化 |
a.Ag(NH3)2++2H2O=Ag++2NH3+H2O
b.AgOH不稳定,极易分解为黑色Ag2O
(I)配制银氨溶液所需的药品是 。
(2)经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O.
①用湿润的红色石蕊试纸检验NH3,产生的现象是 。
②产生Ag2O的原因是 。
(3)该同学对产生银镜的原因提出假设:可能是NaOH还原Ag2O。实验及现象:向AgNO3
溶液中加入 ,出现黑色沉淀;水浴加热,未出现银镜。
(4)重新假设:在NaOH存在下.可能是NH3,还原Ag2O。用右图所示装置进行实验。现象:出现银镜。在虚线框内画出用生石灰和浓
氨水制取NH3的装置简图(夹持仪器略)。
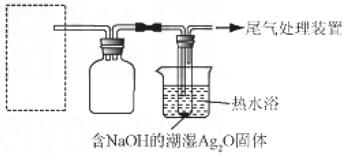
(5)该同学认为在(4)的实验中会有Ag(NH3)2OH生成。由此又提出假设:在NaOH存在下,可能是Ag(NH3)2OH也参与了NH3还原Ag2O的反应.进行如下实验:
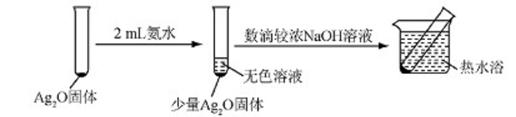
①有部分Ag2O溶解在氨水中,该反应的化学方程式是 。
②实验结果证实假设成立,依据的现象是 。
(6)用HNO3消洗试管壁上的Ag,该反应的化学方程式是 。
:(1)AgNO3溶液和氨水;(2)①试纸变蓝;②在NaOH存在下,加热促进NH3.H2O的分解,逸出NH3,促使Ag(NH3)2++2H2O Ag++2NH3.H2O平衡正向移动,c(Ag+)增大,Ag+和OH-反应立即转化为Ag2O:2Ag++2OH-=Ag2O↓+H2O;(3)过量NaOH溶液;(4)
Ag++2NH3.H2O平衡正向移动,c(Ag+)增大,Ag+和OH-反应立即转化为Ag2O:2Ag++2OH-=Ag2O↓+H2O;(3)过量NaOH溶液;(4) ;(5)①Ag2O+4NH3.H2O= 2Ag(NH3)2OH+3H2O;②与溶液接触的试管壁上析出银镜;(6)Ag+2HNO3(浓)=AgNO3+NO2↑+H2O。
;(5)①Ag2O+4NH3.H2O= 2Ag(NH3)2OH+3H2O;②与溶液接触的试管壁上析出银镜;(6)Ag+2HNO3(浓)=AgNO3+NO2↑+H2O。
:(1)配制银氨溶液时,所使用的试剂是:AgNO3溶液和氨水;(2)①用湿润的红色石蕊试纸检验NH3时,会观察到试纸变蓝;②生成Ag2O的原因是:在NaOH存在下,加热促进NH3.H2O的分解,逸出NH3,促使Ag(NH3)2++2H2O Ag++2NH3.H2O平衡正向移动,c(Ag+)增大,Ag+和OH-反应立即转化为Ag2O:2Ag++2OH-=Ag2O↓+H2O;(3)若是NaOH还原Ag2O时,可向其中加入过量NaOH溶液;(4)石灰和浓氨水制取NH3的最简装置为:
Ag++2NH3.H2O平衡正向移动,c(Ag+)增大,Ag+和OH-反应立即转化为Ag2O:2Ag++2OH-=Ag2O↓+H2O;(3)若是NaOH还原Ag2O时,可向其中加入过量NaOH溶液;(4)石灰和浓氨水制取NH3的最简装置为: ;(5)①Ag2O溶解在氨水中的反应方程式为:Ag2O+4NH3.H2O= 2Ag(NH3)2OH+3H2O;②由于与溶液接触的试管壁上析出银镜,可证明假设成立;(6)银是不活泼的金属,其和硝酸反应的方程式和铜相似为:Ag+2HNO3(浓)=AgNO3+NO2↑+H2O。
;(5)①Ag2O溶解在氨水中的反应方程式为:Ag2O+4NH3.H2O= 2Ag(NH3)2OH+3H2O;②由于与溶液接触的试管壁上析出银镜,可证明假设成立;(6)银是不活泼的金属,其和硝酸反应的方程式和铜相似为:Ag+2HNO3(浓)=AgNO3+NO2↑+H2O。
