资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。磷尾矿主要含Ca5(PO4)3F和CaCO3•MgCO3。某研究小组提出了磷尾矿综合利用的研究方案,制备具有重要工业用途的CaCO3、Mg(OH)2、P4和H2,其简化流程如下: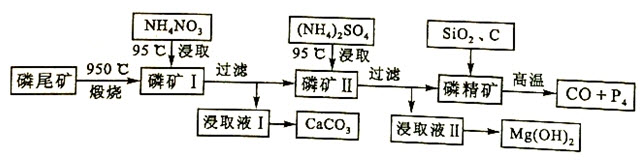
已知:①Ca5(PO4)3F在950℃不分解;
②
请回答下列问题:
(1)950℃煅烧磷尾矿生成气体的主要成分是()。
(2)实验室过滤所需的玻璃仪器是()。
(3)NH4NO3溶液能从磷矿I中浸取出Ca2+的原因是()。
(4)在浸取液II中通入NH3,发生反应的化学方程式是()。
(5)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l)△H=-271kJ/mol
5CaO(s)+H3PO4(l)+HF(g)=Ca5(PO4)3F(s)+5H2O(l)△H=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是()。
(6)在一定条件下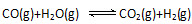 ,当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了5/6.若akg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2()kg。
,当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了5/6.若akg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2()kg。
参考答案:
(1)CO2
(2)漏斗、烧杯、玻璃棒。
(3)NH4+水解使溶液呈酸性,与CaO、Ca(OH)2反应生成Ca2+
(4)MgSO4+2NH3+2H2O===Mg(OH)2↓+(NH4)2SO4。
(5)Ca5(PO4)3F(s)+5H2SO4(l)=5CaSO4(s)+H3PO4(l)+HF(g)△H=-418kJ/mol。
(6)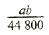
解析:


