问题
问答题
将Cu片插入c(CuSO4)=0.0500mol·L-1的硫酸铜溶液中,Ag片插入AgNO3溶液中组成原电池,电池反应为:2Ag++Cu=2Ag+Cu2+。298.15K时,测得其电动势ε为0.465V。(已知
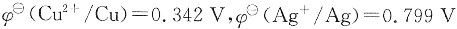 )
)
(1)写出该原电池符号和电极反应式;
(2)计算反应的摩尔吉布斯自由能变和该反应的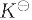 ;
;
(3)计算AgNO3溶液的浓度c(AgNO3)。
答案
参考答案:
(1)(-)Cu|Cu2+(0.0500mol·L-1)‖Ag+(c)|Ag(+)
正极反应:Ag++e=Ag
负极反应:Cu-2e=Cu2+;
(2)△rGm=-nFε=-89.73kJ·mol-1
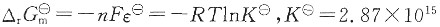
(3)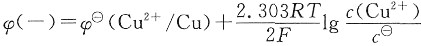
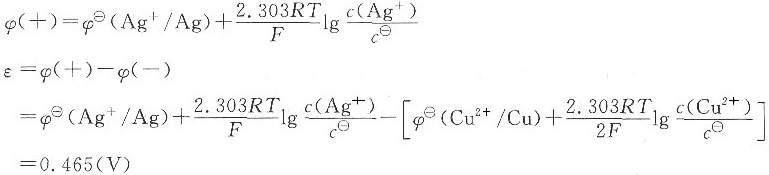
解得:c(Ag+)=0.299mol·L-1
