(14分)
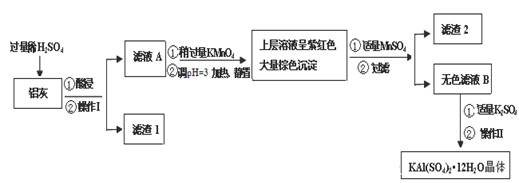
明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al 、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:
回答下列问题:
(1)明矾净水的原理是(用离子方程表示)
(2)操作Ⅰ是 ,操作Ⅱ是蒸发浓缩、 、过滤、 干燥。
(3)检验滤液A中是否存在Fe2+的方法是 (只用一种试剂)
(4)在滤液A中加入高锰酸钾的目的是 ,发生反应的离子方程式为(该条件下Fe2+转化为Fe3+,MnO4- 转化为Mn2+) 。
已知:生成氢氧化物沉淀的pH如下表所示
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释调pH=3的目的 。
(5)己知:在pH=3、加热条件下,MnO4- 可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为: 。滤渣2含有的物质是 。
(6)以Al和NiO(OH)为电极,KOH溶液为电解液可组成新型、高效电池,充放电过程中,发生Ni(OH)2与NiO(OH)之间的转化,写出放电时电池反应的化学方程式 。
(1) Al3+ +3H2O  Al(OH)3 +3H+;(2)过滤 冷却结晶 洗涤
Al(OH)3 +3H+;(2)过滤 冷却结晶 洗涤
(3)取适量滤液A于试管中,滴加铁氰化钾溶液,产生蓝色沉淀,证明Fe2+存在。
(4)使Fe2+转化为Fe3+;5Fe2+ +MnO4- +8H+ ==5Fe3+ +Mn2+ +4H2O;使Fe3+转化成Fe(OH)3沉淀
(5)3Mn2+ +2MnO4- +2H2O=5MnO2 +4H+; MnO2 Fe(OH)3
(6) Al+3NiO(OH)+KOH +H2O=KAlO2+3Ni(OH)2
题目分析:(1)明矾是强酸弱碱盐,弱酸根离子Al3+水解产生氢氧化铝胶体,能够吸附水中悬浮的物质形成沉淀而除去,从而达到达到净水的目的。其反应原理用方程式表示是Al3+ +3H2O  Al(OH)3 +3H+;(2)操作Ⅰ是将难溶性固体与溶液分离的操作,叫过滤。操作Ⅱ是蒸发浓缩、冷却结晶、过滤、洗涤、干燥就得到明矾。(3)检验滤液A中是否存在Fe2+的方法是取适量滤液A于试管中,滴加铁氰化钾溶液,产生蓝色沉淀,证明Fe2+存在。或加入KSCN溶液,无明显变化,在滴加几滴H2O2溶液,溶液变为血红色,就证明含有Fe2+存在。(4)在滤液A中加入高锰酸钾的目的是使Fe2+转化为Fe3+;发生反应的离子方程式为5Fe2+ +MnO4- +8H+ ==5Fe3+ +Mn2+ +4H2O;;根据表中数据可知当溶液的pH=3时Fe3+可以形成沉淀Fe(OH)3。(5)根据题意可得方程式3Mn2+ +2MnO4- +2H2O=5MnO2 +4H+; 由于溶液的pH=3,所以滤渣的成分含有MnO2和 Fe(OH)3。(6)根据题意结合反应条件可知:在放电时,电池反应的化学方程式Al+3NiO(OH)+ KOH +H2O=KAlO2+3Ni(OH)2。
Al(OH)3 +3H+;(2)操作Ⅰ是将难溶性固体与溶液分离的操作,叫过滤。操作Ⅱ是蒸发浓缩、冷却结晶、过滤、洗涤、干燥就得到明矾。(3)检验滤液A中是否存在Fe2+的方法是取适量滤液A于试管中,滴加铁氰化钾溶液,产生蓝色沉淀,证明Fe2+存在。或加入KSCN溶液,无明显变化,在滴加几滴H2O2溶液,溶液变为血红色,就证明含有Fe2+存在。(4)在滤液A中加入高锰酸钾的目的是使Fe2+转化为Fe3+;发生反应的离子方程式为5Fe2+ +MnO4- +8H+ ==5Fe3+ +Mn2+ +4H2O;;根据表中数据可知当溶液的pH=3时Fe3+可以形成沉淀Fe(OH)3。(5)根据题意可得方程式3Mn2+ +2MnO4- +2H2O=5MnO2 +4H+; 由于溶液的pH=3,所以滤渣的成分含有MnO2和 Fe(OH)3。(6)根据题意结合反应条件可知:在放电时,电池反应的化学方程式Al+3NiO(OH)+ KOH +H2O=KAlO2+3Ni(OH)2。
