(6分)由H2、C2H4、C2H2组成的1L混合气体,在一定条件下发生加成反应后,气体总体积变成了XL。请回答(气体体积均在标准状况下测定)
⑴当反应后三种气体均无剩余时,X的取值范围是 ;
⑵若反应后三种气体均无剩余,X=0.4时,原混合气体H2、C2H4、C2H2的体积比为 ;
⑶若X=0.6时,且反应后混合气体密度为0.714g/L时,原混合气体H2、C2H4、C2H2的体积之比为 。
⑴1/3<X<1/2 ⑵3:1:1 ⑶7:2:1
(1)乙烯和乙炔与氢气发生加成反应的方程式分别是CH2=CH2+H2 CH3CH3、C2H2+2H2
CH3CH3、C2H2+2H2 CH3CH3。根据方程式可知,如果恰好是乙烯和氢气加成,则X=0.5;如果恰好是乙炔和氢气加成,则X=1/3,所以X的取值范围是1/3<X<1/2。
CH3CH3。根据方程式可知,如果恰好是乙烯和氢气加成,则X=0.5;如果恰好是乙炔和氢气加成,则X=1/3,所以X的取值范围是1/3<X<1/2。
(2)设原混合气体H2、C2H4、C2H2的体积分别是x、y、z,则根据方程式可知,y+2z=x、x+y+z=1、y+z=0.4,所以解得x=0.6、y=0.2、z=0.2,因此原混合气体H2、C2H4、C2H2的体积比为3︰1︰1。
(3)反应后混合气体密度为0.714g/L,则混合气的平均相对分子质量是0.714。×22.4=16。这说明氢气一定是过量的。因此反应后的气体是乙烷和氢气的混合气,则二者的体积之比是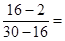 1︰1,所以反应后含有0.3L氢气和0.3L乙烷。设原混合气体H2、C2H4、C2H2的体积分别是a、b、c,则a+b+c=1、b+c=0.3,所以a=0.7。又因为b+2c=0.7-0.3=0.4,所以c=0.1,则b=0.2,因此原混合气体H2、C2H4、C2H2的体积比为7︰2︰1。
1︰1,所以反应后含有0.3L氢气和0.3L乙烷。设原混合气体H2、C2H4、C2H2的体积分别是a、b、c,则a+b+c=1、b+c=0.3,所以a=0.7。又因为b+2c=0.7-0.3=0.4,所以c=0.1,则b=0.2,因此原混合气体H2、C2H4、C2H2的体积比为7︰2︰1。
