在物理课外活动中,某同学制作了一个简单的多用电表,图1为电表的电路图。已知选用的电流表内阻Rg=10 Ω、满偏电流Ig=10mA ,当选择开关接3时为量程250V的电压表。该多用电表表盘如图2所示,下排刻度均匀,C为上排刻度线的中间刻度,由于粗心上排刻度线对应数据没有标出。
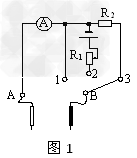
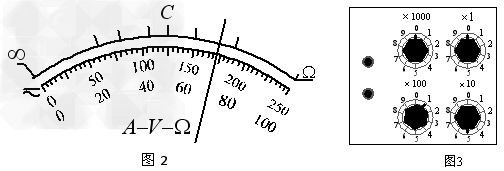
(1)若指针指在图2所示位置,选择开关接1时其读数为 ;选择开关接3时其读数为 。
(2)为了测该多用电表电阻档的电阻和表内电源的电动势,某同学在实验室找到了一个电阻箱,设计了如下实验:
①将选择开关接2,红黑表笔短接,调节R1的阻值使电表指针满偏;
②将电表红黑表笔与电阻箱相连,调节电阻箱使电表指针指C处,此时电阻箱的示数如图3,则C处刻度应为 Ω。
③计算得到多用电表内电池的电动势为 V。(保留2位有效数字)
(3)调零后将电表红黑表笔与某一待测电阻相连,若指针指在图2所示位置,则待测电阻的阻值为 Ω。(保留2位有效数字)
(1)6.90mA(6.84~6.96mA都给分);173V (171~175V都给分)
(2)150;1.5
(3)67(65~69都给分)

 CO(g)
CO(g) CH3OH(g)
CH3OH(g)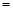 kJ;
kJ;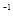 )
)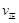 (甲醇)
(甲醇) 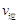 (水)(填“>”、“<”或“=”)。
(水)(填“>”、“<”或“=”)。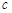 (CH3OH)
(CH3OH) (CH3OH)
(CH3OH)