阅读理解。
It took me three long and hard years to get a lovely little dog named Dion.
My family and I met it at a dog show. We drove for four hours to its owner's house where she showed
us three little dogs, two males and one female. They were so lovely with their little legs, long bodies and heads
that looked too big for their bodies. It took me a long time to decide which one I wanted,but I finally decided
when the female came up to me and licked (舔) my face.
My mother and I took Dion to a kindergarten (幼稚园) for little dogs. She was very shy and hid from
people. But she was very friendly with the other dogs.
If you want to get a dog, think about your time and the work you must do. I walk Dion four to six times
a day. I feed her, spend time with her and watch her when she is out of her doghouse. Even if my favorite TV
program is on, or a good part in a movie is coming up, I still have to take care of her. It is a lot of work to
keep her clean. Sometimes when I brush her I end up with hair all over me.
But I think it is all worth it. Dion also gives her love to me in return. She is always there to lick me and lie
on me. I like playing with her. I think she can tell when I am happy, sad, angry or troubled. Dion is not only
my dog, but she is also my friend.
1. What does Dion look like?
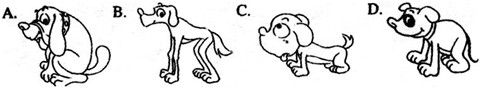
2. The writer finally decided to take Dion because _____.
A. it was very clean
B. it was the youngest one
C. it was very quiet
D. it was friendly to him
3. Paragraph 4 tells us that keeping a dog is a _____ job.
A. hard
B. funny
C. popular
D. dirty
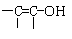 结构的物质) 。
结构的物质) 。 (每个1分)
(每个1分) CH3CH2OH
CH3CH2OH  =0.2mol,n(H2O)=
=0.2mol,n(H2O)= =0.2mol,n(O2)=
=0.2mol,n(O2)=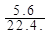 ="0." 25mol
="0." 25mol
