(16分)MnO2与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,K2MnO4溶液经酸化后转化为MnO2和KMnO4。一种MnO2制备KMnO4的方法如下:
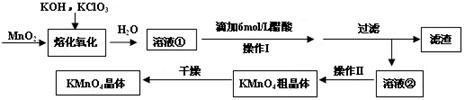
(1)写出“溶化氧化”的化学反应方程式: ;
(2)从溶液②中得到KMnO4粗晶体的方法是 ;
(3)上述流程中可以循环使用的物质是 ;
(4)理论上(若不考虑制备过程中的损失与物质循环)1mol MnO2可制的 mol KMnO4;
(5)已知293K时醋酸钾的溶解度为217g,硫酸钾的溶解度为11.1g,请解释酸化过程中采用醋酸而不采用盐酸或硫酸的原因:
①不采用盐酸的原因: ;
②不采用硫酸的原因: 。
(6)采用上述流程制备KMnO4产率并不高,为提高产率,还可以采用以下两种方法:
①在K2MnO4溶液中通入氯气,写出该反应的离子方程式 ;
②电解K2MnO4溶液,电解的总反应离子方程式为 。
(1)6KOH + KClO3 + 3MnO2 3K2MnO4 + KCl + 3H2O (3分)
3K2MnO4 + KCl + 3H2O (3分)
(2)蒸发浓缩、冷却结晶、过滤 (2分)
(3)MnO2 (2分)
(4)2/3 (2分)
(5)①盐酸具有还原性,高锰酸钾具有强氧化性,会产生氯气 (1分)
②硫酸钾溶解度降低,在蒸发浓缩过程中容易析出而造成产品高锰酸钾纯度下降(1分)
(6)2MnO42- + Cl2 = 2MnO4- + 2Cl-(2分)
2MnO42- + 2H2O = 2MnO4- + 2OH- + H2↑(3分)
题目分析(1)第一步从流程中找到反应物和部分生成物,再根据电荷守恒配平相应变价的元素,最后用电荷守恒进一步配平即可
(2)关键在于审题“溶液②中得到KMnO4粗晶体”
(3)可循环物质为可以从“加进去”和“析出来”的物质进行考滤
(4)根据6KOH + KClO3 + 3MnO2 = 3K2MnO4 + KCl + 3H2O
和 3MnO42- + 4H+ = 2MnO4- + MnO2 ↓+ 2H2O
建立关系式:3MnO2~ 3MnO42-~ 2MnO4-
根据系数进行计算即可
(5)①由制氯气的方法盐酸与高锰酸钾反应可知
②由给出的溶解度“硫酸钾的溶解度为11.1g”可知
(6)①由题意可知,锰酸钾要转化为高锰酸钾要被氧化,而氯气则充当氧化性
②锰酸钾要转化为高锰酸钾,则锰酸根要在阳极放电,根据锰酸钾溶液的离子成份,类似于电解饱和食盐水。
