请用化学用语填空:
(1)现有氧化铁、空气、铁粉、氯酸钾、液态氧、水、氯化钾、海水等物质,其中属于化合物的是_______,属于氧化物的是________。
(2)图甲表示____的原子结构示意图;甲、乙两图所示元素形成的化合物的化学式为_______。请写出家庭厨房中含有甲图中元素的一种物质___________。

(3)自来水厂常用漂白粉对饮用水等进行消毒。漂白粉的有效成分是Ca(ClO)2,氯元素的化合价是____价;某化工厂生产的次氯酸钙消毒粉优等品中氯元素质量分数为32.3%,由此推断该消毒粉是____(填“纯净物”或“混合物”)。
(1)Fe2O3、KClO3、H2O、KCl;Fe2O3、H2O
(2)Na;Na2O(其他合理答案也可);NaCl(或NaHCO3或Na2CO3等合理答案)
(3)+1;混合物

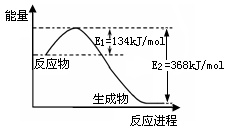
 2NH3(g)+CO2(g) 在不同温度下,该反应平衡状态部分数据见右表。下列说法正确的是
2NH3(g)+CO2(g) 在不同温度下,该反应平衡状态部分数据见右表。下列说法正确的是 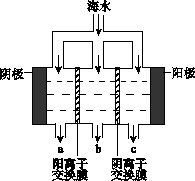 电渗析法淡化海水示意图如下图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
电渗析法淡化海水示意图如下图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。