(10分)学习了MnO2对过氧化氢有催化作用的知识后。某同学想:CuO能否起到类似MnO2的催化剂作用呢?于是进行了如下探究。
【猜想】Ⅰ. CuO不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ. CuO参与反应产生O2,反应前后质量和化学性质发生了改变;
Ⅲ. CuO是反应的催化剂,反应前后______________________________。
【实验】用天平称量0.2gCuO,取5ml5%的过氧化氢溶液于试管中,进行如下实验:
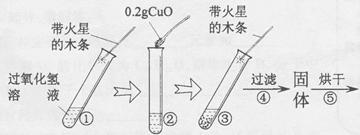
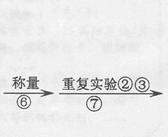
(1)填写下表:
| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
|
带火星的木条复燃 |
| 溶液中有气泡放出
| 猜想Ⅰ、Ⅱ不成立 猜想Ⅲ成立 |
(3)步骤⑦的目的是 ;
(4)过氧化氢能被CuO催化分解放出氧气的文字表达式为___________ _______;
【拓展】过氧化氢溶液完全分解后得到的液体是 (填纯净物或混合物),多少克过氧化氢中含的氧元素质量与54g水中所含的氧元素质量相等?
Ⅲ、CuO是反应的催化剂,反应前后CuO的质量和化学性质不变
(1)填写下表:
| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
| 溶液中有气泡放出 带火星的木条复燃 | 固体质量仍为0.2g | 溶液中有气泡放出 带火星的小木条复燃 | 猜想Ⅰ、Ⅱ不成立 猜想Ⅲ成立 |
(3) 证明氧化铜的化学性质在反应前后没有发生改变
(4) 略
【拓展】 纯净物
计算过程: 51g (列式正确1分,答案正确1分)
题目分析::Ⅲ、催化剂的特点是“一变,两不变”,即反应速率变,质量和化学性质不变.
(1)氧化铜对过氧化氢的分解有催化作用,能加快其分解速率生成氧气的速率,故现象是有气泡,带火星的木条复燃;催化剂的特点是“一变,两不变”,反应前后其质量不变,所以氧化铜的质量仍为0.2g;催化剂的特点是“一变,两不变”,其中反应速率改变,这里是加快,所以现象是溶液中有气泡放出,带火星的木条复燃.
(2)为了看氧化铜是否能改变反应的速率,要通过加入氧化铜与不加氧化铜的现象进行对比,才能得出科学合理的结论.
(3)过滤用到的仪器有:铁架台(带铁圈)、漏斗、烧杯、玻璃棒,缺少最后一种,注意仪器与材料或用品不同.
(4)经过④过滤后得到的是固体,说明CuO难溶于水.
故答案为:Ⅲ、质量和化学性质不变;
(1)填表:
| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
| 溶液中有气泡放出 带火星的木条复燃 | 固体质量仍为0.2g | 溶液中有气泡放出 带火星的小木条复燃 | 猜想Ⅰ、Ⅱ不成立 猜想Ⅲ成立 |
(3)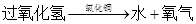 ;
;
(4)根据元素质量分数的公式来(某元素的质量分数=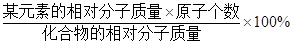 )计算.
)计算.
解:设X克过氧化氢中含有的氧元素跟54克水中的氧元素相等。
X·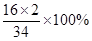 =54×
=54×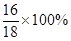
X=51克
答:51克过氧化氢中含的氧元素质量与54g水中所含的氧元素质量相等.
点评:催化剂、催化作用是初中重要基本概念之一,是考查的重点和热点,主要考查对催化剂、催化作用概念的理解,对催化效率影响因素的探究等.
