(7分)小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%。老师说,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种。
(1)小亮查阅氢氧化钙常温下的溶解度为0.18g后,认为该溶液不可能是氢氧化钙溶液,理由是 。
(2)小亮取少量样品于试管中,滴加 试液,试液变红色,该溶液不可能是 。
(3)为了进一步确定该溶液的成分,小亮设计了以下实验方案:
方案A:选择稀盐酸来确定该溶液的成分;
方案B:选择无色酚酞试液来确定该溶液的成分;
你认为以上方案中合理的是 ,若选择一种常见的碱溶液来确定,有关反应
的化学方程式为 。
(4)小亮通过上述方法证明该溶液的成分为NaOH,于是他取一定体积的NaOH溶液
(20℃),并向其中滴加10%的盐酸(20℃),测得反应中溶液的温度与加入盐酸体积的变化如下。
| 加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 溶液温度 (t)/℃ | 25.2 | 29.6 | 32.0 | 36.0 | 38.2 | 36.7 | 35.7 | 34.7 | 33.7 | 32.9 |
①加入盐酸的量在2~10 mL之间时 。
②加入盐酸的量在10~20 mL之间时 。
(1)氢氧化钙的溶解度为0.18g,其该温度下的饱和溶液的质量分数不可能是10%
(2)无色酚酞 NaCl溶液
(3)A Ca(OH)2 + Na2CO3 ="=" CaCO3↓+ 2NaOH
(4)①氢氧化钠与盐酸反应放热 ②盐酸过量起冷却降温作用
题目分析:(1)氢氧化钙常温下的溶解度为0.18g,该溶液不可能是氢氧化钙溶液,理由是当该温度下氢氧化钙溶液达到饱和时,其溶质质量分数=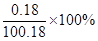 =0.18%小于10%。
=0.18%小于10%。
(2)取少量样品于试管中,滴加无色酚酞试液,试液变红色,说明该溶液呈碱性,该溶液不可能是NaCl溶液。
(3)为了进一步确定该溶液的成分,应该选择稀盐酸来确定该溶液的成分,因为如果是碳酸钠溶液,则滴加稀盐酸后会有气泡产生;若是氢氧化钠溶液则没有气泡;若选择一种常见的碱溶液来确定,应该选用氢氧化钙溶液,有关反应的化学方程式为Ca(OH)2 + Na2CO3 ="=" CaCO3↓+ 2NaOH。
(4)由表中数据可知,
①加入盐酸的量在2~10 mL之间时,溶液温度上升,说明氢氧化钠与盐酸反应放热。
②加入盐酸的量在10~20 mL之间时,溶液温度逐渐下降,因为此时反应已经停止,盐酸过量,起到了冷却降温作用。
点评:本题考查的知识点较多,其中溶解度和溶质质量分数的灵活运用是解题的开始。
