某化学小组用一定量AgNO3和Cu(NO3)2混合溶液进行了图实验, 并对溶液A和固体B的成分进行了分析和实验探究。
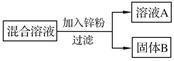
【提出问题】溶液A中的溶质可能有哪些?
【作出猜想】①只有Zn(NO3)2 ② Zn (NO3)2、AgNO3 ③ Zn (NO3)2、Cu(NO3)2
④Zn (NO3)2、AgNO3、Cu(NO3)2
【交流讨论】不合理的猜想是 (填标号),其理由是
。
【实验探究】若猜想①成立,通过以下实验可确定固体B的成分,请将下表填写完整。
| 实验步骤 | 现象 | 结论及反应原理 |
| 取少量B,滴加 | 有气泡产生 | 结论: 化学方程式: |
猜想②中无Cu(NO3)2,说明Cu(NO3) 2已与Zn反应生成Cu,而Cu能与AgNO3反应,故也不可能有AgNO3【或Zn应先与AgNO3反应后与Cu(NO3)2反应,当有AgNO3剩余时,溶质中一定含有Cu(NO3)2】(1分)
| 实验步骤 | 现象 | 结论 |
| 稀盐酸(或稀硫酸等)(1分) | Ag、Cu、Zn(2分) Zn + H2SO4 =ZnSO4 + H2↑(2分) |
题目分析:【交流讨论】不合理的猜想是②,理由是猜想②中无Cu(NO3)2,说明Cu(NO3) 2已与Zn反应生成Cu,而Cu能与AgNO3反应,故也不可能有AgNO3;【或Zn应先与AgNO3反应后与Cu(NO3)2反应,当有AgNO3剩余时,溶质中一定含有Cu(NO3)2】。
【实验探究】若猜想①成立,通过以下实验可确定固体B的成分:
| 实验步骤 | 现象 | 结论及反应原理 |
| 取少量B,滴加稀盐酸(或稀硫酸等) | 有气泡产生 | 结论:Ag、Cu、Zn 化学方程式:Zn + H2SO4 =ZnSO4 + H2↑ |
点评:书写化学方程式,要遵守质量守恒定律,注意化学反应的条件,配平、气体或者沉淀的符号。
