Na、Mg、Al分别与盐酸反应。
(1)若盐酸足量,等物质的量的Na、Mg、Al产生的氢气质量之比为_______________。
(2)若盐酸足量,等质量的Na、Mg、Al产生H2的质量之比为_______________,溶液增重质量之比为_______________。
(3)若盐酸等质量且足量,充分反应后所得溶液质量相等,则Na、Mg、Al质量之比为_______________。
(4)若盐酸浓度相等,体积相等,投入的Na、Mg、Al质量相等,反应后有一种金属剩余,该金属是_______________。
(5)称取Na、Mg、Al各m g,在室温下分别与V L 4 mol·L-1的盐酸充分反应,试推断,在下 * * 种情况下,V的取值范围(用含m的表达式表示)。
①Al与盐酸反应放出H2最多时,______________。
②Na与盐酸反应放出H2最多时,______________。
③Mg和Al与盐酸反应产生H2一样多时,______________。
(1)1∶2∶3
(2)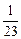 ∶
∶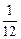 ∶
∶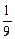
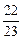 ∶
∶ ∶
∶
(3)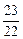 ∶
∶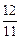 ∶
∶
(4)Al
(5)①V>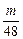 L ②V<
L ②V<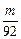 L ③V≤
L ③V≤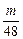 L
L
(1)盐酸足量,有下列关系:
2Na+2HCl====2NaCl+H2↑
1 mol 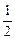 mol
mol
Mg+2HCl====MgCl2+H2↑
1 mol 1 mol
2Al+6HCl====2AlCl3+3H2↑
1 mol 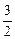 mol
mol
所以Na、Mg、Al产生氢气质量之比为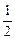 ∶1∶
∶1∶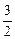 =1∶2∶3。
=1∶2∶3。
(2)2Na+2HCl====2NaCl+H2↑
 mol
mol  mol
mol
Mg+2HCl====MgCl2+H2↑
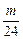 mol
mol 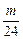 mol
mol
2Al+6HCl====2AlCl3+3H2↑
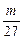 mol
mol 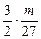 mol
mol
所以Na、Mg、Al产生氢气质量之比为 mol∶
mol∶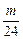 mol∶
mol∶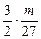 mol=
mol=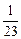 ∶
∶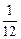 ∶
∶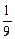 。
。
(3)依题意知溶液增加质量相同。设加入Na、Mg、Al的质量分别为x、y、z。
2Na+2HCl====2NaCl+H2↑
2 mol 1 mol
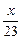 mol
mol 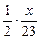 mol
mol
Mg+2HCl====MgCl2+H2↑
1 mol 1 mol
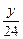 mol
mol 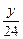 mol
mol
2Al+6HCl====2AlCl3+3H2↑
2 mol 3 mol
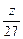 mol
mol  mol
mol
即Na与盐酸反应后溶液增重:x-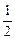 ·
·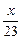 ·2=
·2= g
g
Mg与盐酸反应后溶液增重:y-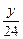 ·2=
·2=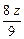 g
g
Al与盐酸反应后溶液增重:z-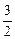 ·
·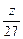 ·2=
·2=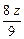 g
g
即有: =
=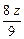 =
=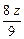
x∶y∶z=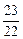 ∶
∶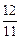 ∶
∶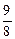
(4)由2Na+2HCl====2NaCl+H2↑
Mg+2HCl====MgCl2+H2↑
2Al+6HCl====2AlCl3+3H2↑
知等质量的Na、Mg、Al,Al消耗HCl最多,所以当只有一种金属剩余时,只能是Al。
(5)求Na、Mg、Al m g消耗HCl的体积(4 mol·L-1)。
2Na + 2HCl====2NaCl+H2↑
 mol
mol  mol
mol
V(HCl)=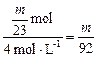 L
L
Mg + 2HCl====MgCl2+H2↑
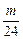 mol
mol 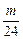 ·2 mol
·2 mol
V(HCl)=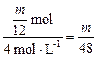 L
L
2Al + 6HCl====2AlCl3+3H2↑
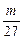
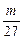 ·3 mol
·3 mol
V(HCl)=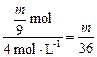 L
L
①保证等m的Na、Mg、Al与盐酸反应,Al产生的H2最多,即Na、Mg无剩余,HCl过量即可,即V(HCl)>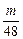 L。
L。
②保证等m的Na、Mg、Al与盐酸反应,Na产生H2最多,即Na过量,HCl不足,即V(HCl)<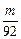 L。
L。
③等质量的Na、Mg、Al与盐酸反应,Mg、Al产生H2一样多,即Mg、Al与盐酸反应时,HCl都不足或Mg恰好反应完全,即V(HCl)≤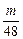 L。
L。
