(1)A为用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)的装置.
①电解一段时间后,B中出现浑浊现象,请用离子方程式表示原因______.
此时电极a附近的现象为______,因此工业上电解所用的食盐水需精制.
②随反应的进行,C中溶液红色褪去,主要原因有两种可能.请按要求填写表格.
| 假设 | 主要操作 | 现象 | 结论 |
| 假设1: | |||
| 假设2:可能是H+与OH-中和,导致溶液褪色 |
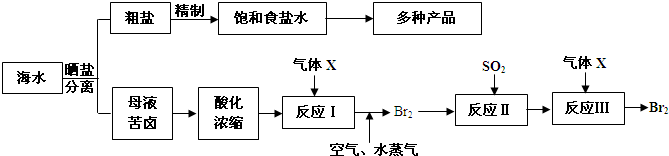
请回答:
①气体X的化学式为______,反应II的化学方程式为______.
②在母液苦卤中含有较多的NaCl、KCl、MgCl2、MgSO4等物质.用沉淀法测定苦卤中镁元素的含量(g/L),实验过程中应测定的数据有______.
③电解200kg 质量分数为25%的饱和食盐水,当浓度下降到20%时,收集到氯气的物质的量为______(溶于溶液中的氯气忽略不计,计算结果保留一位小数).
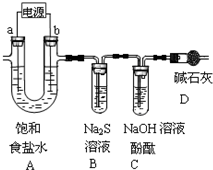
(1)惰性电极电解饱和食盐水,发生2NaCl+2H2O
2NaOH+H2↑+Cl2↑, 电解 .
①氯气在b电极生成后在B中与硫化钠发生氧化还原反应,该离子反应为Cl2+S2-=2Cl-+S↓,氢气在a电极产生,生成的NaOH与镁离子反应,观察到有无色气泡产生,溶液出现浑浊,
故答案为:Cl2+S2-=2Cl-+S↓;有无色气泡产生,溶液出现浑浊;
②C中溶液红色褪去,主要原因有两种可能,若为HClO的强氧化性褪色,则漂白性后再滴加酚酞不会恢复,或褪色的溶液中滴加NaOH溶液,颜色不会恢复,故答案为:
| 假设 | 主要操作 | 现象 | 结论 |
| 假设1:Cl2与水反应生成有强氧化性的HClO,有漂白作用使红色褪去 | 取少量褪色溶液于试管中,滴加酚酞 | 显红色 | 假设1正确 |
| 假设2: |
| 假设 | 主要操作 | 现象 | 结论 |
| 假设1:Cl2与水反应生成有强氧化性的HClO,有漂白作用使红色褪去 | 取少量褪色溶液于试管中,加入适量NaOH溶液 | 显红色 | 假设2正确 |
| 假设2: |
(2)①由流程可知,X为Cl2,具有氧化性,能将溴离子氧化为溴单质,该离子反应为SO2+Br2+2H2O=2HBr+H2SO4,故答案为:Cl2;SO2+Br2+2H2O=2HBr+H2SO4;
②用沉淀法测定苦卤中镁元素的含量(g/L),应知道溶液的体积及Mg元素的质量,则需测定苦卤样品的体积、Mg(OH)2沉淀的质量,故答案为:苦卤样品的体积、Mg(OH)2沉淀的质量;
③电解200kg 质量分数为25%的饱和食盐水,当浓度下降到20%时,参加反应的NaCl为xmol,由2NaCl+2H2O
2NaOH+H2↑+Cl2↑,则 电解 .
×100%=20%,解得x=195.4mol,所有氯气的物质的量为200000×25%-x×58.5g/mol 200000-2x-71x
=97.7mol,故答案为:97.7mol.195.4mol 2
