在密闭容器中有H2、O2、Cl2的混合气体。电火花点燃,容器中的三种气体恰好完全反应,冷却到室温后得到液体产物的溶质质量分数是33.6%,则容器中原H2、O2、Cl2的体积比是()
A.2∶1∶1
B.9∶4∶1
C.4∶2∶2
D.9∶4∶3
答案:B
本题主要考查Cl2和非金属的反应及溶质的质量分数的计算方法。
解法一:常规方法。
设原混合气体中分别含O2体积是x,Cl2体积是y。据题意,当产物中HCl气体溶于生成的水中得到盐酸。由阿伏加德罗定律,V1∶V2=n1∶n2。
2H2+O2 2H2O
2H2O
(2x) x (2x)
H2+Cl2 2HCl
2HCl
(y) y (2y)
33.6%=2y×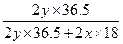 ×100%,
×100%,
解得x∶y=4∶1由于V(H2)=2x+y,
则V(H2)∶V(O2)∶V(Cl2)=9∶4∶1。
选B。
解法二:挖潜法。
通过反应方程式2H2+O2 2H2O和H2+Cl2
2H2O和H2+Cl2 2HCl,仔细观察题中所溶物质的体积,挖掘出潜在关系:H2的总物质的量等于O2的物质的量的两倍加上Cl2的物质的量。故
2HCl,仔细观察题中所溶物质的体积,挖掘出潜在关系:H2的总物质的量等于O2的物质的量的两倍加上Cl2的物质的量。故
V(H2)=2V(O2)+V(Cl2),分析选项,只有B才能恰好完全反应:9=2×4+1。
