(7分)已知20℃时NaCl的溶解度为36 g。某氯碱厂使用的设备是阳离子交换膜电解槽,若一次向电解槽中加入一定量20℃时饱和NaCl溶液,当90%的NaCl电解时,阴极收集到11. 2 m3气体(已折算成标准状况)。请回答下列问题:
(1)该反应的离子方程式为 。
(2)取阳极区溶液作系列实验,下列结论中错误的是 。(填字母)
A.滴加酚酞试剂,先变红后褪色
B.滴加硝酸银溶液,有白色沉淀产生
C.滴加小苏打溶液,有气泡产生
D.做焰色反应实验呈黄色(3)计算原饱和NaCl溶液的质量 kg(精确到0.1kg)。
(4)若电解90%的NaCl所需电能是由甲烷燃料电池提供,则所需甲烷至少 m3?
(甲烷的电极反应式:CH4+10OH--8e— = CO32—+7H2O
假设该燃料电池的能量利用率为90%。折算成标准状况。精确至0.1 m3)
(1)2Cl—+2H2O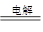 2OH—+Cl2↑+H2↑(2分)
2OH—+Cl2↑+H2↑(2分)
(2)A(2分) (3)245.6 kg(1分) (4)3.1m3(1分)
(1)惰性电极电解氯化钠溶液,阴极是氢离子放电,阳极是氯离子放电,总反应式为2Cl—+2H2O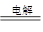 2OH—+Cl2↑+H2↑。
2OH—+Cl2↑+H2↑。
(2)阳极是氯离子放电,生成氯气,氯气溶于水生成次氯酸,显酸性,所以选项A是错误的,不可能变红色。其余选项都是正确的。
(3)设原饱和NaCl溶液的质量是x。阴极收集的气体是氢气,物质的量是500mol,所以被电解的氯化钠是1000mol,质量是58500g。所以有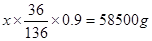 ,解得x=245.6kg。
,解得x=245.6kg。
(4)反应中转移电子是1000mol,所以需要甲烷是1000÷8÷0.9=138.9mol,其体积约是3.1m3。
