(4分)用石墨电极电解100 mLH2SO4和CuSO4的混合液,通电一段时间,两极上均产生2.24L(标准状况)气体,则原混合液中Cu2+的浓度是多少?
(4分)1mol/L 2CuSO4 +2H2O 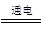 2Cu+O2↑+ 2H2SO4 2H2O
2Cu+O2↑+ 2H2SO4 2H2O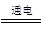 2H2↑ + O2↑ 写出电解总反应式给1分。 若用电子守恒法也对,给4分
2H2↑ + O2↑ 写出电解总反应式给1分。 若用电子守恒法也对,给4分
n(H2)=n(O2)=0.1mol
n(e-)总= 0.4mol
n(e-)铜=" 0.4mol" - 2 n(H2)=0.2mol
n(Cu) =" 0.1" mol
C(Cu2+) =" 0.1mol/0.1L=1" mol/L
考查电化学的有关计算。
通电一段时间,两极上均产生2.24L(标准状况)气体,所以电解时发生反应的方程式依次是2CuSO4 +2H2O 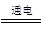 2Cu+O2↑+ 2H2SO4和2H2O
2Cu+O2↑+ 2H2SO4和2H2O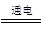 2H2↑ + O2↑。
2H2↑ + O2↑。
由于n(H2)=n(O2)=2.24L÷22.4L/mol=0.1mol
所以转移电子是n(e-)总= 0.4mol
因此根据电子的得失守恒可知
n(e-)铜= 0.4mol - 2 n(H2)=0.2mol
所以n(Cu) =0.1 mol
因此c(Cu2+) = 0.1mol÷0.1L=1 mol/L
