某课外活动小组同学用下图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题。
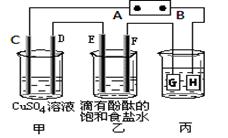
(1)A为电源的 极;
(2)E的电极反应式为: ;
(3)在常温下,现用丙装置给铁镀铜,当丙中铁表面析出铜的3.2g时,乙中溶液的PH值为 (假设溶液体积为1L);
(4)在电解一段时间后在甲中加入适量 可以使溶液恢复到原来的浓度。
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为______________。
(8分)(1)负极(1分) (2)2H++2e-=H2↑(2分) (3)13 (2分)
(4)CuO或CuCO3[若考虑到水开始电解Cu(OH)2也可以](1分)(5)4H++O2+4e-=2H2O(2分)
题目分析:(1)一段时间后在C电极表面有铜析出,这说明C电极是阴极,溶液中的铜离子放电而析出铜。所以A电极是电源的负极。
(2)E电极和电源的负极相连,做阴极,则溶液中的氢离子放电,电极反应式为2H++2e-=H2↑。
(3)3.2g铜的物质的量=3.2g÷64g/mol=0.05mol,转移0.05mol×2=0.1mol电子。根据得失电子守恒可知,乙池中也转移0.1mol电子。所以根据方程式2NaCl+2H2O 2NaOH+H2↑+Cl2↑可知,每产生1mol氢氧化钠反应中就转移1mol电子,因此反应中生成的氢氧化钠是0.1mol,其浓度是0.1mol/L,所以溶液中氢离子浓度是10-13mol/L,则pH=13。
2NaOH+H2↑+Cl2↑可知,每产生1mol氢氧化钠反应中就转移1mol电子,因此反应中生成的氢氧化钠是0.1mol,其浓度是0.1mol/L,所以溶液中氢离子浓度是10-13mol/L,则pH=13。
(4)惰性电极电解;硫酸铜溶液的生成物是氧气、稀硫酸和铜,即减少的是氧原子和铜原子,所以要使溶液恢复到原来的浓度应该向甲中加入适量CuO或CuCO3。
(5)原电池中负极失去电子,正极得到电子。根据反应式2Cu+O2+2H2SO4=2CuSO4+2H2O可知,氧气得到电子,因此氧气在正极得到电子。由于溶液显酸性,则正极电极反应式为4H++O2+4e-=2H2O。
