问题
选择题
500 mL KNO3和Cu(NO3)2的混合溶液中c(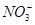 )=6.0 mol·L-1,用石墨做电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
)=6.0 mol·L-1,用石墨做电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
A.原混合溶液中c(K+)为2 mol·L-1
B.上述电解过程中共转移6 mol电子
C.电解得到的Cu的物质的量为0.5 mol
D.电解后溶液中c(H+)为2 mol·L-1
答案
答案:A
C项,根据题意:阳极反应为4OH-+4e-=2H2O+O2↑,阴极反应为Cu2++2e-=Cu、2H++2e-=H2↑;根据阴、阳两极上转移电子相同可列出2n(Cu)+2n(H2)=4n(O2),则n(Cu)=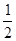 (1 mol×4-1 mol×2)=1 mol;A,溶液中c(K+)+2c(Cu2+)=c(
(1 mol×4-1 mol×2)=1 mol;A,溶液中c(K+)+2c(Cu2+)=c(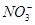 ),则c(K+)=2 mol·L-1;B项,根据阳极反应,产生22.4 L O2,转移4 mol电子;D项,根据电极反应,阳极消耗4 mol OH-,阴极消耗2 mol H+,故电解后溶液中
),则c(K+)=2 mol·L-1;B项,根据阳极反应,产生22.4 L O2,转移4 mol电子;D项,根据电极反应,阳极消耗4 mol OH-,阴极消耗2 mol H+,故电解后溶液中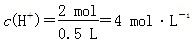 。
。
