问题
问答题
由实验测知:取3.5gKMnO4晶体加热到220°C,分解放出的氧气多于按下式计算的理论量.按下式计算的理论量为放出氧气0.354g,2KMnO4
K2MnO4+MnO2 +O2↑(溶于水呈紫红色)(溶于水呈绿色)(黑色,不溶)△ .
换算成标准状况下的体积为248mL,而实际测得的氧气为308mL(标准状况),超过理论量为:(308-248)m1,=60mL.
试回答:
(1)怎样用实验证明:超理论量的氧气不是来自MnO2?______
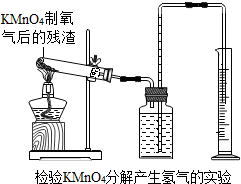
(2)怎样用实验证明超理论量的氧气是由K2MnO4分解产生的?(要求用KMnO4制取氧气后的残渣实验,如图所示.)______
(3)怎样从“最后残渣”中分离出MnO2?______.
答案
(1)氧气能使带火星的木条复燃,应另取少量二氧化锰加热,用带火星的木条检验生成物中是否有氧气.故答案为:另取少量MnO2,在酒精灯火焰上加热,插入带火星的木条,木条不复燃
(2)氧气能使带火星的木条复燃,应继续加热残渣,用带火星的木条检验生成物中是否有氧气.故答案为:用酒精灯火焰集中加热“残渣”,插入带火星的木条,木条复燃
(3)最后残渣中的二氧化锰不溶于水,其余的都溶于水,应先将混合物加水溶解,使之变成固体和液体的混合物,而分离混合物中的固体和液体一般用过滤的方法.故答案为:将“最后残渣”加入适量的水溶解,过滤,即可分离出MnO2
