海水是取之不尽的化工原料资源库,从海水中可提取各种化工原料。下列是工业上对海水的几项综合利用的示意图:
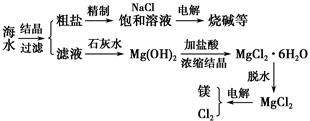
试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:A.盐酸;B.BaCl2溶液;C.NaOH溶液;D.Na2CO3溶液。加入试剂的顺序是________________________________________________________________。
(2)电解饱和食盐水时,与电源正极相连的电极上发生的反应为________。与电源负极相连的电极附近溶液pH________(填“变大”“不变”或“变小”)。若1 mol电子的电量为96 500 C,则用电流强度为100 A的稳恒电流持续电解3分13秒,则在两极上共可收集到气体________mL(STP)。若保证电解后饱和食盐水的浓度不变,则可采取的方法是________________________________________________________________。
(3)由MgCl2·6H2O晶体脱水制无水MgCl2时,MgCl2·6H2O晶体在________气氛中加热脱水,该气体的作用是_____________________________________________________。
(4)电解无水MgCl2所得的镁蒸气可以在下列________气体中冷却。
A.H2 B.N2 C.CO2 D.O2
(1)BCDA或CBDA (2)2Cl--2e-=Cl2↑ 变大 4 480 向电解液中通入一定量的HCl气体
(3)HCl 抑制Mg2+水解 (4)A
(1)该小题属离子除杂题。除杂原则是在除去Ca2+、Mg2+、SO42-时,不能带入杂质离子。所以,解此题的关键是把握好加入离子的顺序:①Ba2+必须在CO32-之前加入;②CO32-、OH-必须在H+之前加入,所以B、C不分先后,而D、A本身既分前后,又必须放在B、C之后才能满足条件。
(2)电解饱和食盐水时,与正极相连的阳极发生的反应是:2Cl--2e-=Cl2↑,与负极相连的阴极发生的反应是:2H++2e-=H2↑。H+不断消耗,使得溶液中c(OH-)增大,pH变大。电解中外逸的是Cl2、H2,所以要确保原溶液浓度不变,只能向体系中通入一定量的HCl气体以补足损失的氢、氯。易错处是加入盐酸,使溶液浓度变小。
(3)抑制水解平衡MgCl2+H2O Mg(OH)Cl+HCl正向移动。
Mg(OH)Cl+HCl正向移动。
(4)镁蒸气可以与氮气、氧气和二氧化碳反应,所以只能用氢气来冷却。
