问题
计算题
(8分)将一定质量的Mg-Al合金投入500 mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加 5 mol· L-1 NaOH溶液至过量,生成的沉淀质量与加入的NaOH溶液的体积关系如下图所示。
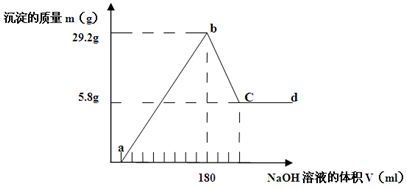
求: (1)原合金中Mg、Al质量各多少克? Mg g , Al g。
(2)b-c段反应的离子方程式为
(3) HCl物质的量浓度 mol/L
答案
(1)2.4g 8.1g (2)Al(OH)3+OH-=AlO2-+2H2O (3)1.8
向溶液中滴加NaOH溶液过程中所涉及反应为:
①H++OH-=H2O ②Mg2++2OH-=Mg(OH)2 ③ Al3++3OH-=Al(OH)3
③Al(OH)3+OH-=AlO2-+2H2O
(1)由Mg~Mg(OH)2可知铝粉的质量为: =2.4 g
=2.4 g
Al~Al(OH)3可知铝粉质量为: =8.1g
=8.1g
(2)在b点时溶液呈中性,酸提供的氢离子与碱提供的氢氧根离子的物质的量相等,则盐酸的物质的量浓度为:c(HCl)×0.5=0.18×5,即c(HCl)=1.8 mol/L
