(6分)利用“化学计量在实验中的应用”的相关知识进行填空
(1)含有6.02×1023个氧原子的H2SO4的物质的量是_________
(2)将4 g NaOH溶解在10 mL水中,再稀释成1 L,从中取出10 mL,这10 mL溶液的物质的量浓度为_______。
(3)将50 mL 0.1 mol·L-1 NaCl和50 mL 0.5 mol·L-1 CaCl2溶液混合后,若溶液的体积为二者体积之和,则混合溶液中c (Cl-)为______________。
(每空2分,共6分)(1)0.25mol (2)0.1mol/L (3)0.55mol/L
题目分析:(1)根据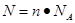 可知,含有6.02×1023个氧原子物质的量是
可知,含有6.02×1023个氧原子物质的量是
6.02×1023÷6.02×1023/mol=1mol。所以根据硫酸的化学式H2SO4可知,硫酸的物质的量是1mol÷4=0.25mol。
(2)根据n=m/M可知,4g氢氧化钠的物质的量是4g÷40g/mol=0.1mol。依据c=n/V可知,该溶液的浓度是0.1mol÷1L=0.1mol/L。由于溶液是均一的,所以取出的10ml溶液其浓度还是0.1mol/L。
(3)混合前氯化钠和氯化钙中氯离子的物质的量分别是0.05L×0.1mol/L=0.005mol、0.05L×0.5mol/L×2=0.05mol。所以混合后氯离子的物质的量是0.005mol+0.05mol=0.055mol。而溶液的体积是100ml,所以混合后氯离子浓度是0.055mol÷0.1L=0.55mol/L。
点评:在进行物质的量的有关计算时,关键是熟练应用几个关系式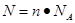 、n=m/M、
、n=m/M、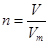 、
、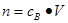 ,特别还要注意气体摩尔体积和阿伏加德罗定律的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。如果是计算溶液中离子浓度,还需要注意溶质的化学式以及对应的电离方程式,才能准确计算某离子浓度。如果是计算离子的物质的量,还需要注意溶液的体积变化。
,特别还要注意气体摩尔体积和阿伏加德罗定律的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。如果是计算溶液中离子浓度,还需要注意溶质的化学式以及对应的电离方程式,才能准确计算某离子浓度。如果是计算离子的物质的量,还需要注意溶液的体积变化。