问题
计算题
(10分)将体积为100 mL浓度为2.0 mol·L־1 的CuSO4溶液和体积为300 mL浓度为1.0 mol·L־1 的H2SO4溶液混合,假定混合后溶液体积为400 mL。计算:
(1)混合液中CuSO4的物质的量浓度是 ,H2SO4的物质的量浓度是 。
(2)往混合液中加水稀释至Cu2+ 浓度为0.2 mol·L־1,则稀释后溶液的体积为 。
(3)稀释后溶液中H+ 的物质的量浓度是 ,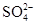 的物质的量浓度是 。
的物质的量浓度是 。
答案
(1) 0.5 mol·L־1 0.75 mol·L־1 (2)1000mL (3)0.6 mol·L־1 0.3 mol·L־1
题目分析:(1)n(CuSO4)=0.2mol n(H2SO4)=0.3mol,混合后溶液的体积为400mL,所以c(CuSO4)=0.5mol/L c(H2SO4)=0.75mol。
(2)根据c(稀)V(稀)=c(浓)V(浓)有0.2 mol·L־1×V=0.5mol/L×400mL,则V=1000mL。
(3)n(H+)=0.6mol n(SO42-)=0.3mol,溶液体积为1L,则c(H+)=0.6mol/L,c(SO42-)=0.3mol/L。
点评:本题很基础,难度小,适合于训练学生的基础能力。