现有MgCl2和Al2(SO4)3混合溶液,向其中不断加入Na2O2,得到沉淀的量与加入Na2O2的物质的量如图所示,原溶液中Cl-与SO42-的物质的量之比为 ( )
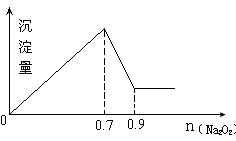
A.1:3
B.2:3
C.6:1
D.3:1
答案:A
题目分析:MgCl2和Al2(SO4)3都会与NaOH反应生成溶解度较低的碱性沉淀,
MgCl2 + 2NaOH = 2NaCl + Mg(OH)2↓(白色不溶于水的沉淀)
Al2(SO4)3 + 6NaOH = 3Na2SO4 + 2Al(OH)3↓(白色不溶于水的沉淀)而Al(OH)3具有两性,即可溶于酸,又可溶于强碱。
Al(OH)3 + NaOH = NaAlO2(偏铝酸钠) + 2H2O(沉淀消失)这就是为什么反应后段沉淀量会急剧下降的原因。
根据反应方程:
Al(OH)3 + NaOH = NaAlO2 + 2H2O
1-------------------1--------------1------------2
可知:NaOH用量是0.2体积,所以Al(OH)3也必然是0.2体积,
而Al全部来源于Al2(SO4)3,在Al2(SO4)3中Al:(SO4)2- = 2:3,
所以可推出(SO4)2-体积必为 0.3体积沉淀达到最大量时NaOH用量是0.7体积,
又可推断出Al3+在变为Al(OH)3时又已经消耗了NaOH 0.6体积,
可推断与MgCl2反应的NaOH用量是0.1体积(0.7-0.6),
MgCl2 + 2NaOH = 2NaCl + Mg(OH)2↓,
1 2 2 1
0.05 0.1
而在MgCl2中,Mg:Cl = 1:2
所以Cl用量必为 0.1体积。
所以Cl- :(SO4)2- = 0.1体积:0.3体积 = 1:3。故选择 A。
点评:本题考查的是化学的基本计算,发生的反应都源自于教材内容,因此熟悉常见无机物之间的反应是解决此类问题的关键。
