(3分)现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量(mol)的关系如图
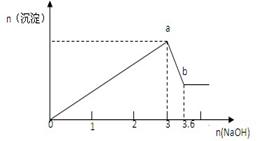
计算
(1)a处沉淀的总物质的量 mol
(2)c(FeCl3)= mol/L
(3)c(AlCl3)= mol/L
(1)1 (1分) (2) 4 (1分)(3) 6 (1分)
题目分析:设n(Al3+)=n(Al(OH)3)=x,则
由Al(OH)3+OH-═AlO2-+2H2O
1 1
x (3.6-3)mol解得x=0.6mol
设n(Fe3+)=y,则
Al3++3OH-═Al(OH)3↓
0.6mol 1.8mol
Fe3++3OH-═Fe(OH)3↓
1 3
y (3-1.8)mol解得y=0.4mol
则c(FeCl3)=0.4/0.1=4mol/L,c(AlCl3)=0.6/0.1=6mol/L
由Fe3++3OH-═Fe(OH)3↓、Al3++3OH-═Al(OH)3↓可知,a点的沉淀为Fe(OH)3和Al(OH)3,
则a点沉淀的总物质的量为0.4+0.6=1mol。
点评:本题考查金属及化合物的性质,明确发生的化学反应与图象的对应关系是解答本题的关键,然后利用消耗的NaOH的物质的量代入离子反应方程式计算即可解答。
