(7 分)如图所示为实验室常见气体制备,净化、干燥、收集和性质实验的部分仪器。小明同学欲用它们完成以下的探究实验。
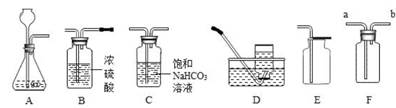
(1)小明要制取一瓶纯净、干燥的二氧化碳气体。
①用 E 装置而不用D 装置收集二氧化碳的原因是 。
②若用 F 装置来收集二氧化碳,气体应从 端进入(填“a”或“b”之一) 。
③C 装置通常用来除去二氧化碳中混有的少量氯化氢气体,请写出化学方程式 。
(2)小明在实验室探究盐酸化学性质时,将碳酸钠溶液倒入装有稀盐酸的烧杯中看到有气泡产生。为了解两种物质间的反应情况,他决定从反应后溶液中溶质的组成入手进行探究。
①小明对反应后溶液中溶质的组成有两种猜想,请你再补充一种猜想。
猜想 1:溶质为 NaCl 和 Na2CO3 猜想 2:溶质为 NaCl 和HCl
猜想 3:溶质为 ;
②小明设计两个不同的实验方案,用两种方法验证了猜想 2 成立,填写下表:

③你认为方法二是否正确: (填“正确”或“不正确” ),你的理由是 。
(1)① 二氧化碳的密度比空气大,且二氧化碳能溶于水
② a ③ NaHCO3+HCl═NaCl+H2O+CO2↑
(2)① NaCl(或氯化钠) ②气泡 ③ 不正确
NaCl也能与硝酸银反应生成白色氯化银沉淀,所以不能证明是否含有盐酸
题目分析:(1)收集装置的选择依据是:气体的密度和溶解性,所以用E装置而不用D装置收集二氧化碳的原因是:二氧化碳的密度比空气大,且二氧化碳能溶于水
②二氧化碳的密度比空气大,若用 F 装置来收集二氧化碳,气体应从a端进入
③C 装置通常用来除去二氧化碳中混有的少量氯化氢气体,化学方程式为:NaHCO3+HCl═NaCl+H2O+CO2↑
(2)①反应后溶液中溶质的成分:生成物一定有,反应物可能有(可能过量),所以猜想 3:溶质为:NaCl(或氯化钠),两者恰好反应
②根据酸的性质,能与活泼金属反应,故取少量反应后的溶液,加入锌粒,实验现象:有气泡产生
③方法二不正确,原因是NaCl也能与硝酸银反应生成白色氯化银沉淀,所以不能证明是否含有盐酸
